2023-07-31 来源 : 王伟强博士
新药开发是一个复杂的系统工程。
为什么这样说呢?
目前,成功研发一款1类新药,平均需要10年时间,耗资26亿美元。
新药研发至少包括如下6个环节:
(1)新药发现(discovery )
(2)新药的化学、生产和质控(chemical, manufacture and control, CMC)
(3)临床前动物试验(动物药理学和毒性)
(4)临床试验(1期、2期和3期临床试验)
(5)申报上市
(6)市场推广
每一个环节的失败都会导致新药研发整体的失败。
即使是成功进入1期临床试验的新药,最终也只有10%的概率获批上市。
下面,我们以新药研发的临床试验阶段为例,来聊聊新药研发的复杂性和系统性。
一、临床试验1、2、3期
临床试验阶段是新药开发耗费资金最多的阶段(约占60%),也是耗时最长的阶段(通常需要5-6年)。
新药获批上市前,通常需要开展1期、2期和3期临床试验。
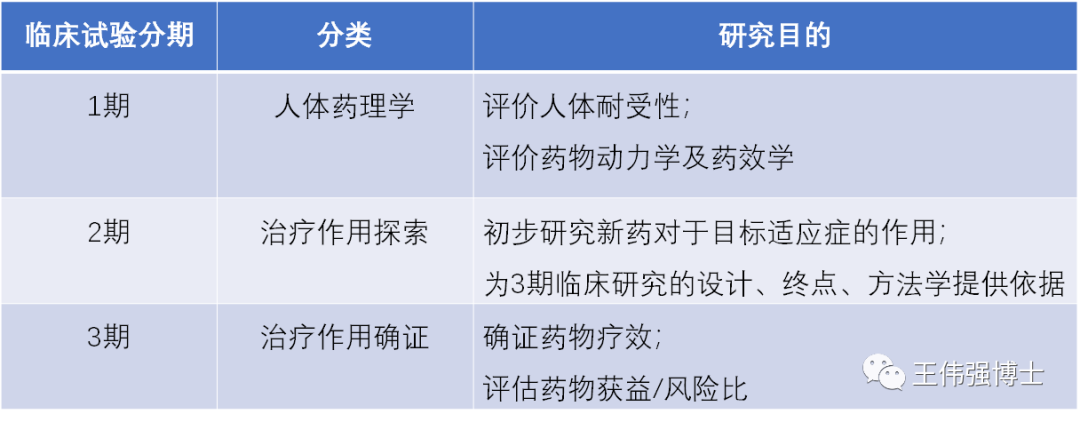
1. 临床试验1期
临床试验1期是首次将新药用于人体的临床试验阶段,通常需要入组20-80患者的小样本人群。
临床试验1期的主要目标是评估新药在人体内的安全性和耐受性。
安全性通过记录患者发生的不良事件(AE)来体现。
耐受性通过人体剂量递增试验(如3+3剂量递增)发现人体最大耐受剂量。
临床试验1期也会初步评估新药的疗效,并在后续的2期和3期临床试验中进一步确证疗效。
同时,临床试验1期会研究新药的药理学,即PK(药代动力学)和PD(药效学)。
PK就是评估药物在人体内的ADME。
ADME=Absorption(吸收), Distribution(分部), Metabolism(代谢)和Excretion(排泄),有时也考虑Toxicity(毒性)和Liberation(释放),也被简写为LADME, ADMET或LADMET。

比如,一个口服的小分子药物,PK就是评估口服小分子药物后在胃肠道的吸收、进入血液后在人体组织中的分布、之后在肝脏等器官的代谢、最后通过尿、汗液、胆汁、乳汁,甚至呼吸等排泄出体外。
药效学,即药物效应动力学(Pharmacodynamics),是研究药物对疾病的效果及药物剂量对疗效的影响。PD研究的内容主要包括:
(1)观测生理机能的改变。
如新药对中枢神经系统产生兴奋还是抑制;对心肌收缩力或胃肠道运动是加强还是减弱;对血管或支气管是扩张还是收缩等。
(2)测定生化指标的变化。
如血糖、电解质;生理活性物质,如血管紧张素、前列腺素、环磷苷浓度的改变等。
(3)观测组织形态学变化。
如血细胞大小、甲状腺大小、肾上腺皮质萎缩等。
2. 临床试验2期
临床试验2期,又称为探索性临床试验,是在比临床试验1期更大的人群(通常需要入组100-300位患者)验证新药的安全性和疗效。
临床试验2期的主要目标,是在1期探索到的安全剂量范围内,确定新药产生疗效的最佳剂量。
3. 临床试验3期
III期临床试验,通常要入组1,000-3,000受试者(根据临床试验预设终点计算样本量),其结果决定新药能否最终获批上市。
III期临床试验,又称为确证性临床试验,主要用来回答一个问题:新药的受益/风险比如何?
如果受益>风险,则会获批上市。
如果获益<风险,则会被拒绝上市。
二、临床试验主要完成哪些工作?
无论是1期、2期,还是3期临床试验,都包括如下几部分:
(1) 受试者筛选
这是一个看似简单、但会是临床试验进度的限速步骤之一。
完全符合入组要求的“完美患者”其实并不多。常常需要专业的受试者招募公司从研究中心(临床试验实施的医院)之外的地方医院寻找合适的受试者。
(2) 研究药物用药
不同的研究药物有不同的剂型和使用方法。
确保受试者按照要求按时按量用药,也是临床试验成败的关键之一。
(3) 新药安全性和疗效数据的记录
记录临床试验期间受试者的安全性和疗效数据,是体现研究者(医生)和临床试验运营团队专业性的重要方面之一。
(4)数据的收集和分析
临床试验数据的收集需要借助专业的线上数据录入系统(EDC, electronic data capture)。EDC的根据病理报告表(CRF, case report form)的内容来设计。
临床试验数据的分析需要数据(DM, data manager )和生物统计(biostatistician)共同完成。
(5)结果报告
临床试验结果的报告由医学团队(CRP, clinical research physician )主导完成。
临床试验结果呈现的文件主要是临床研究报告(CSR, clinical study report)。
三、临床试验会涉及哪些功能团队?
临床试验需要多个不同职能的团队高效合作,包括:
医学团队(临床研究医生)、临床运营、研究者(参与临床试验的临床医生)、统计师、数据经理、注册团队、药物警戒、医学写作、数据质量保证团队等。
• 医学团队:负责临床试验方案设计、医学监察、数据解读和报告等。
• 临床运营:负责临床试验的启动、实施、研究中心管理、数据监查等。
• 研究者:参与临床试验的临床医生,分为主要研究者(PI)和协助研究者(sub-I),是临床试验的具体执行人,负责受试者的治疗和安全。
• 统计师:又称为生物统计师,根据临床试验方案对疗效和安全性终点的要求,对临床试验产生的数据进行统计分析。
• 数据经理:负责监查临床试验数据在EDC系统的录入是否规范,并对数据质量问题提出质疑和修正建议。
• 注册团队:负责监督临床试验按照药监局的法规和指南开展,并负责与药监局直接沟通,申请临床试验许可或新药上市许可。
• 药物警戒:对临床试验过程中受试者出现的严重不良时间(SAE, severe adverse event)进行监管,确保SAE报告的规范性,并负责向药监局汇报SAE的整体情况和受试者的整体安全性。
• 医学写作:负责临床试验相关文件的撰写,如试验方案、知情同意书、研究者手册、研究报告等。
• 数据质量保证(QA, quality assurance) :负责临床试验质量的稽查,包括GCP执行情况、数据收集、数据管理、数据报告等。
结语
新药临床试验是一项极为复杂的系统工程,需要多团队的密切配合,才能把一款新药成功开发出来。
在我国,新药研发是一个正在逐步兴起的高科技领域。
祝愿你也能在这个冉冉升起的行业中寻找到自己的机会,实现自己的价值。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)