甲硫氨酸是一种含硫的必需氨基酸,它不仅用于蛋白质合成,而且在调控甲基化反应、含硫氨基酸代谢、维持氧化还原稳态以及信号传导等方面也发挥重要作用。由于甲硫氨酸只能从食物中获取,且很多肿瘤细胞的生长都高度依赖于外源性的甲硫氨酸,因此使得膳食甲硫氨酸限制成为一种极具潜力的肿瘤治疗策略。前期的大量研究表明,甲硫氨酸限制饮食能够抑制多种类型的肿瘤在小鼠体内的生长,并且增强肿瘤对化疗和放疗的敏感性。然而,甲硫氨酸饮食干预对靶向肿瘤铁死亡疗法以及免疫治疗的影响尚不清楚。铁死亡是一种铁依赖的、异常脂质过氧化物累积所触发驱动的调节性细胞死亡方式。目前已发现它与肿瘤、神经退行性疾病、心血管疾病和急性肾损伤等生理病理过程密切相关。在肿瘤免疫微环境中,CD8+ T细胞能够抑制微环境内的胱氨酸代谢,增强肿瘤细胞对铁死亡的敏感性,并且铁死亡诱导剂能够逆转肿瘤细胞对免疫治疗的抗性,从而和PD-1抗体发挥协同抗肿瘤活性。在大多数细胞中,半胱氨酸-GSH-GPX4轴是最主要的保护细胞免于铁死亡的代谢通路。细胞内的大部分半胱氨酸都来自于胞外摄取的胱氨酸,但也有少部分可通过甲硫氨酸的转硫途径生成。虽然甲硫氨酸能够参与胞内GSH的合成,但其缺乏或饮食干预对肿瘤细胞铁死亡的影响仍不明确。近日,华中科技大学基础医学院王维民研究团队(博士研究生薛莹和讲师吕付佳为共同第一作者)在 Nature Communications 期刊发表了题为:Intermittent dietary methionine deprivation facilitates tumoral ferroptosis and synergizes with checkpoint blockade 的研究论文。该研究发现甲硫氨酸的长时缺乏和短暂饥饿对肿瘤细胞铁死亡具有截然相反的调控作用。在体内,饮食中甲硫氨酸的间歇性剥夺可显著增强肿瘤对铁死亡的敏感性,并且与PD-1抗体协同抑制肿瘤进展,增强T细胞介导的抗肿瘤免疫反应。1)饮食中甲硫氨酸的长时缺乏会抑制肿瘤的铁死亡,而间歇性的甲硫氨酸缺乏则会促进肿瘤铁死亡。作者首先在体外的氨基酸剥夺实验中发现胱氨酸单独缺乏可以显著诱导铁死亡的发生,但甲硫氨酸的同时缺乏非但没有促进铁死亡,反而抑制了胱氨酸缺乏诱导的铁死亡。之后检测细胞内的GSH含量发现,虽然单独缺乏胱氨酸或甲硫氨酸都能够降低细胞内的GSH含量,但甲硫氨酸的同时缺乏逆转了胱氨酸缺乏导致的GSH下降。更有意思的是,当作者对肿瘤细胞进行短暂的(8h)甲硫氨酸饥饿预处理后再给予胱氨酸单独缺乏的处理,反而促进了肿瘤细胞的铁死亡,同时促进了胞内GSH含量的下降。在荷瘤小鼠中,长期给予甲硫氨酸缺乏的饮食则会抑制肿瘤铁死亡的发生,而间歇性的甲硫氨酸饮食缺乏能够显著增强肿瘤对铁死亡诱导剂的敏感性。2)甲硫氨酸的短暂饥饿增强肿瘤细胞对CD8+ T细胞的敏感性。在肿瘤细胞与特异性CD8+ T共培养的体系中,作者发现甲硫氨酸的短暂饥饿也会显著增强肿瘤细胞对CD8+ T细胞介导的杀伤作用。由于分子机制研究发现甲硫氨酸的短暂饥饿通过上调CHAC1的表达,增强GSH的降解,从而促进铁死亡的发生。因此肿瘤细胞CHAC1的缺失能够抑制铁死亡,同时也会抑制CD8+ T细胞对肿瘤细胞的杀伤作用。3)间歇性甲硫氨酸饮食缺乏、铁死亡诱导剂和PD-1抗体的三重组合疗法,能够显著抑制肿瘤进展并延长荷瘤小鼠的生存期。 已发现间歇性甲硫氨酸饮食缺乏单独处理就能够抑制肿瘤生长。进一步,作者还探索了间歇性甲硫氨酸饮食缺乏与PD-1抗体在体内的联合治疗效果。结果显示二者联合能够显著抑制肿瘤的生长并增强T细胞免疫应答,且联合治疗效果显著优于单独治疗。最后,作者发现使用间歇性甲硫氨酸饮食缺乏联合铁死亡诱导剂IKE和PD-1抗体的组合疗法,能够最大限度地抑制肿瘤进展并延长小鼠的生存期。综上所述,这项研究深入揭示了甲硫氨酸对细胞铁死亡调控作用的两面性,阐明了甲硫氨酸代谢、肿瘤铁死亡和抗肿瘤免疫反应之间的相互作用,革新了人们对于特殊饮食在体内生理条件下调控组织细胞死亡和免疫反应的理解和认知,为饮食干预氨基酸代谢用于肿瘤治疗的临床转化奠定了理论基础。甲硫氨酸的长时缺乏和短暂饥饿对铁死亡的不同调控作用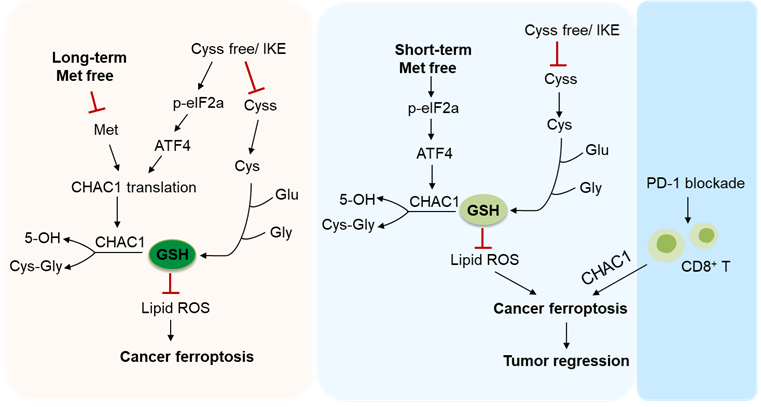
www.nature.com/articles/s41467-023-40518-0
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。







发表评论
注册或登后即可发表评论
登录注册
全部评论(0)