2023-12-29

1.加速通道(Fast Track):这个项目允许药企在药物研发的早期阶段就申请,主要基于药物具有的潜力。获得此通路的药物,FDA会提供更多的指导,并允许在部分临床数据出来后即进行滚动审查,从而加快整个研发过程。
2.突破性疗法(Breakthrough Therapy):这个项目针对的是在早期临床试验中表现出有很大提升潜力的药物。FDA将委派资深工作人员提供密集的指导。同样,这也使得药物可以更快地进入市场。
3.优先审评(Priority Review):这是一个加速审批的机制,承诺在6个月内给予回复。它加快了药物的审批过程,使得药企可以在更短的时间内获得批准并上市。
4.加速批准(Accelerated Approval):这是唯一一个基于替代性或中间临床终点的审批通路。它允许药企在二期临床试验进行申请,并在获得批准后进行后续的研究或三期试验以验证药物的有效性。

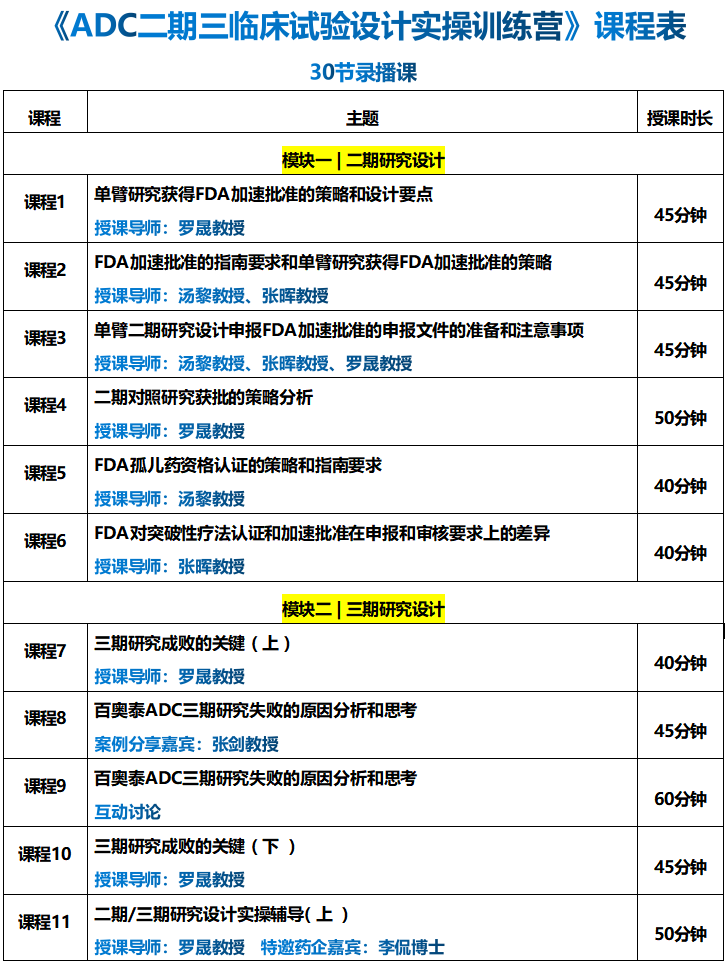
本期,我们了解“孤儿药的资格认定”的申请和策略分析,授课导师是来自美国圣犹达儿童研究医院的汤黎教授。
孤儿药(Orphan drug)是指针对罕见病人群的小众药物,由于这些药物市场规模较小,导致药企研发回报率较低,因此很少有制药企业关注其治疗药物的研发。为了鼓励研发,美国FDA在1983年通过了孤儿药法案,从税收减免、免申请费、研发资助、加快审批、市场独占权等多个层面激励研发。
对于罕见病的定义和药物研发的加速项目,不同的国家和地区可能会有不同的规定和政策。在美国,罕见病是指那些在特定区域内相对罕见的疾病。这些疾病可能在中国并不罕见,但在美国却是被定义为罕见的。因此,药企在进行药物研发时需要充分了解当地的法规和政策,以便更好地制定战略和计划。
孤儿药认定资格对于制药企业和投资机构来说具有重要意义。首先,孤儿药认定资格意味着该药物具有治疗罕见病的潜力,这为制药企业提供了巨大的市场机会;其次,获得孤儿药认定资格的药物可以享受一系列的激励政策,如税收减免、研发资助、市场独占权等,这有助于降低研发成本,提高研发效率,加速药物上市进程。
常见问题:
1. 如果罕见病人数多于20万例,是不是就无法申请孤儿药资格认定?
2. 价格和病人依从度是FDA主要考虑的因素吗?
3. 如果药物活性成分从未被批准过,申请FDA孤儿药认证时,不一定需要临床数据,其他类型的数据也可以被接受的吗?
4. 如果药物对病人的护理有重大贡献(例如将输液药物改为口服药),FDA会认可吗?
5. 引用FDA或数据库的资料来证明该疾病是罕见病是否足够?
6. 已获批上市的非孤儿药是否可以申请孤儿药认定?
课程内容:
1. 孤儿药资格认定的背景、定义和分类
2. 孤儿药资格认定的特殊优惠政策支持
3. FDA孤儿药资格认定的目的和程序
4. 孤儿药资格认定需要满足哪些条件
5. 孤儿药资格认定需要提交哪些材料
6. FDA孤儿药资格认定项目的限制条件
7. 孤儿药资格认定的常见问题和解决方法
8. 申请FDA孤儿药资格认定的策略
授课导师:
罗晟教授/美国杜克大学医学中心
汤黎教授/美国圣犹达儿童研究医院
课程试听:






添加小编微信

百度浏览 来源 : 国际临研
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。




发表评论
注册或登后即可发表评论
登录注册
全部评论(0)