
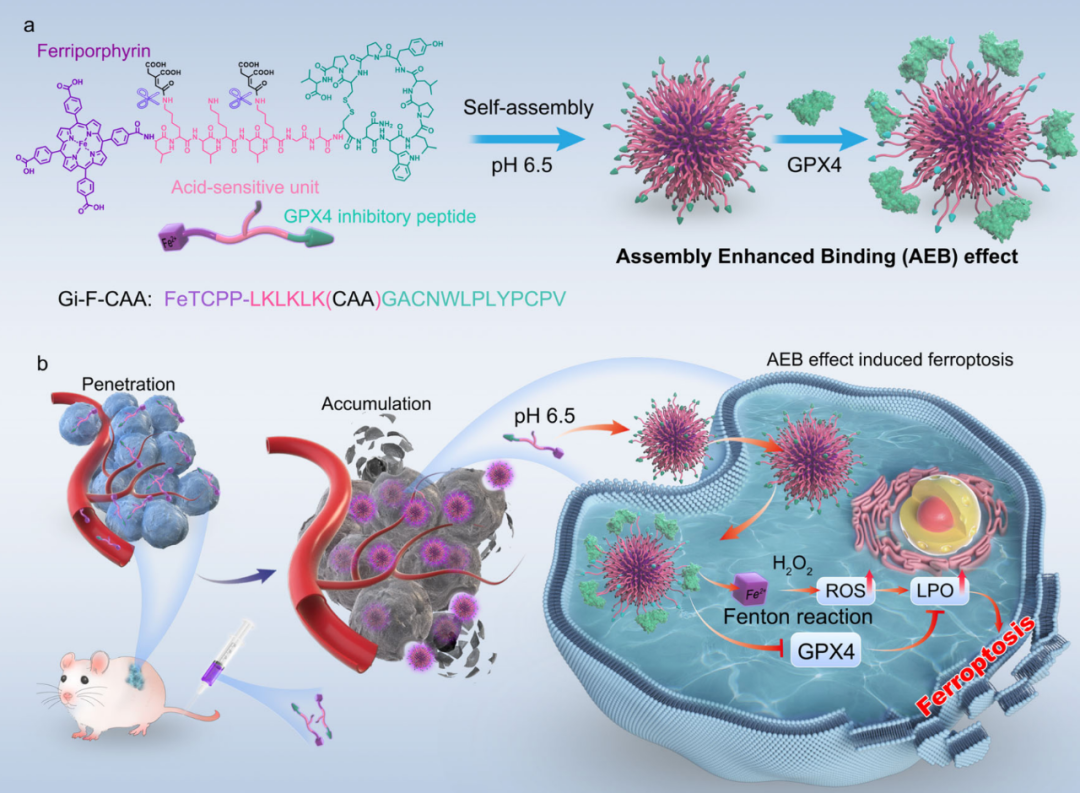
铁死亡(Ferroptosis)是一种铁依赖的非凋亡形式的程序性细胞死亡,其特征是铁介导的氧化应激异常升高和谷胱甘肽(GSH)耗竭,导致致命的脂质过氧化物(LPO)过度积累。随着对分子机制的深入理解,谷胱甘肽过氧化物酶4(GPX4)已被广泛报道是保护细胞免受铁死亡毒性脂质过氧化物的关键调节因子,其在肿瘤组织中比在相邻正常组织中高表达。新的证据表明,GPX4抑制剂对铁死亡的激活越来越被认为是一种重要的肿瘤抑制治疗策略。然而,由于GPX4抑制剂的肿瘤递送效果差和对铁死亡的非特异性激活,其在肿瘤治疗中的广泛应用受到了阻碍。2024年1月11日,国家纳米科学中心王浩研究员、乔增莹研究员、哈尔滨医科大学徐万海教授、武汉理工大学孙涛垒教授等在 Nature Communications 上发表了题为:In vivo assembly enhanced binding effect augments tumor specific ferroptosis therapy 的研究论文。该研究利用体内自组装优势,开发了一种具有肿瘤微环境特异性激活的多肽-铁卟啉偶联物——Gi-F-CAA,能够改善肿瘤渗透、内吞和GPX4抑制,最终通过铁死亡增强其抗癌活性。该研究开发的这种具有聚集增强结合效应(AEB)的多肽-铁卟啉偶联物,可以通过诱导肿瘤细胞铁死亡来提高治疗效果,为克服化疗耐药性提供了一种有潜力的替代策略。纳米材料已被证明可以通过复合多种功能性药物来提高传统化疗药物或靶向药物的性能。然而,由于外渗有限、肿瘤间质流体压力升高、肿瘤细胞紧密排列和细胞外基质致密等因素,纳米材料向肿瘤组织以及远端肿瘤细胞的渗透仍然是一个未解决的障碍。利用小分子和纳米科学的优势,先进的生物纳米材料可以更可控地增强细胞毒性药物在肿瘤组织中的渗透、积累和细胞内化,同时保护正常组织和代谢器官。在此基础上,该研究团队开发了一种基于超分子化学的体内自组装策略,该策略已被广泛认为是一种有前途的工具,可以增强细胞毒性药物在其作用部位的积累。例如,原位构建的纤维纳米材料通过多价协同作用明显增强了线粒体的破坏。此外,基于酶激活自组装策略的纳米材料被开发用于精准药物输送,其表现出高渗透深度和改善的肿瘤积累。在这项研究中,研究团队开发了一种具有肿瘤微环境特异性激活的肽-铁卟啉偶联物,用于改善肿瘤渗透和内吞作用,通过聚集增强结合效应(AEB)有效抑制GPX4,最终通过铁死亡提高其抗癌活性。简而言之,GPX4抑制肽(GACNWLPLYPCPV)与pH敏感部分(顺式乌头酸酐,CAA)和铁卟啉(FeTCPP)修饰的组装肽连接子(LKLKLK)偶联产生肽-铁卟啉偶联物——Gi-F-CAA(FeTCPP-LKLKLK(CAA)GACNWLPLYPCPV)。由于CAA修饰后亲水性的改善,单链状态的小尺寸Gi-F-CAA深入渗透到实体肿瘤中。在肿瘤的酸性微环境下,CAA的水解诱导Gi-F-CAA自组装成大纳米颗粒(Gi-F),这是由于疏水相互作用的增强。反过来,这增加了肿瘤内吞效率和随后的肿瘤积累。此外,由于形成的纳米结构提供了GPX4结合位点的增强,Gi-F通过聚集增强结合效应(AEB)在细胞中表现出对GPX4活性的增强抑制作用,增加了基于FeTCPP的Fenton反应产生的活性氧化物(ROS)。这共同通过诱导铁死亡以产生抗肿瘤效应。重要的是,Gi-F-CAA在多个肿瘤模型中表现出潜力,包括膀胱癌、多药耐药乳腺癌和大肾细胞癌。此外,这种肽-铁卟啉偶联物的设计可以用于各种功能性药物的递送,例如化疗药物、多肽药物和荧光造影剂。综上所述,该研究开发了一种具有肿瘤微环境特异性激活的多肽-铁卟啉偶联物——Gi-F-CAA,能够改善肿瘤渗透、内吞和GPX4抑制,最终通过铁死亡增强其抗癌活性。预计这一概念的发展可能会改善功能性药物的肿瘤特异性递送,同时由于其方便的模块化分子修饰而实现功能增强。www.nature.com/articles/s41467-023-44665-2
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。







发表评论
注册或登后即可发表评论
登录注册
全部评论(0)