
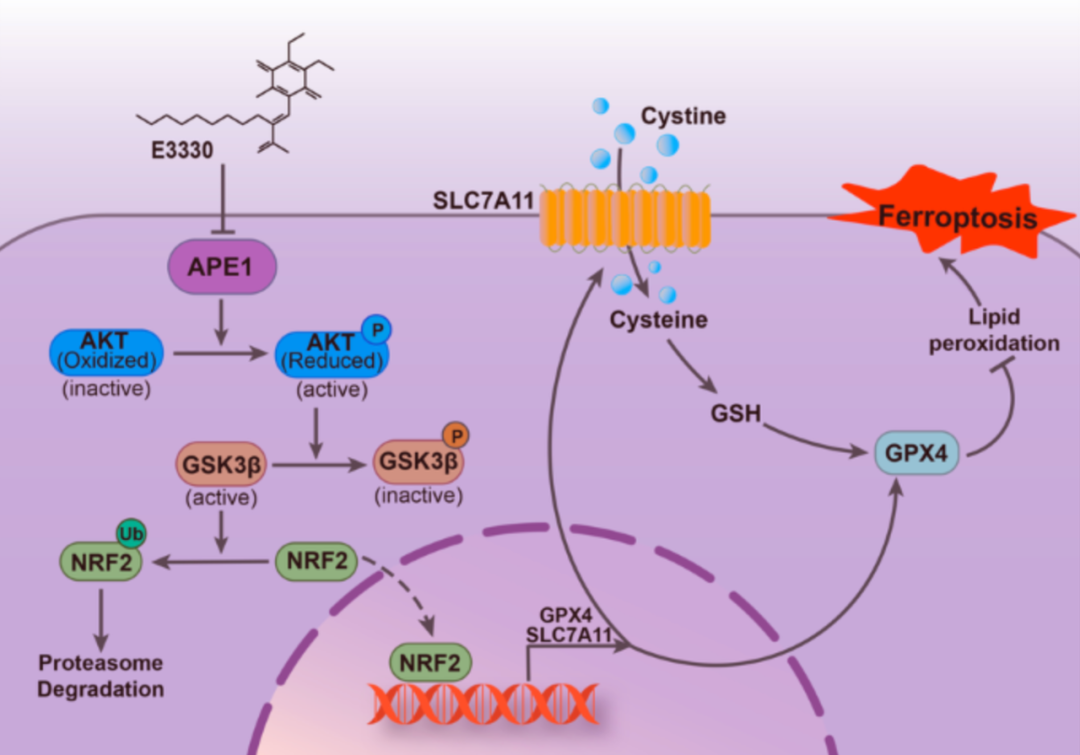
肝细胞癌(Hepatocellular carcinoma,HCC)是癌症相关死亡的主要原因之一。目前,HCC在全球恶性肿瘤中排名第六,致死率第三,并且发病率和死亡率都在不断上升。近年来,尽管针对HCC有多种治疗策略可供选择,包括手术、免疫疗法、靶向疗法或综合疗法,但这些疗法的有效性、有效药物的可用性及其疗效持续时间仍然有限,HCC患者的总体生存率仍不理想。铁死亡(Ferroptosis)是一种铁依赖的非凋亡形式的程序性细胞死亡,其特征是铁介导的氧化应激异常升高和谷胱甘肽(GSH)耗竭,导致致命的脂质过氧化物(LPO)过度积累。近年来的多项研究表明,铁死亡与包括肝细胞癌(HCC)在内的多种癌症的进展和治疗有关。因此,对肝细胞癌中铁死亡调控机制的深入研究,确定有效的治疗靶点,对肝细胞癌的治疗具有重要意义。2024年2月28日,南京师范大学生命科学学院郭志刚/胡志刚教授团队在 Cell Death & Differentiation 期刊发表了题为:APE1 inhibition enhances ferroptotic cell death and contributes to hepatocellular carcinoma therapy 的研究论文。该研究揭示了APE1在调节肝癌细胞铁死亡中的重要作用和具体机制,为肝细胞癌的治疗提供了新靶点和新思路。脱嘌呤/脱嘧啶核酸内切酶1(Apurinic/apyrimidinic endonuclease 1,APE1)是一种多功能酶,不仅具有DNA损伤修复功能,还具有氧化还原功能。APE1的DNA损伤修复功能在碱基切除修复(BER)途径中发挥关键作用,负责修复被氧化应激、烷基化剂和电离辐射破坏的DNA。此外,APE1的氧化还原功能在调节基因表达,以及细胞应对氧化应激方面起着核心作用。据报道,APE1广泛参与各种癌症的进展。值得注意的是,高水平的APE1与肝细胞癌的化疗耐药和不的良临床预后有关。最近,有研究发现,铁死亡过程中持续的氧化应激会上调APE1的表达并增加肿瘤细胞对铁死亡的抵抗性。然而,APE1在肝细胞癌铁死亡中的作用尚不清楚。在这项研究中,研究团队发现APE1缺失显著增加了肝细胞癌(HCC)细胞对铁死亡诱导剂erastin和RSL3的敏感性,促进了铁死亡。分子机制研究表明,APE1参与HCC铁死亡调控依赖其氧化还原功能而非DNA损伤修复功能。抑制 APE1的氧化还原功能会增加氧化态的AKT,抑制了AKT的磷酸化和激活,使下游的GSK3β去磷酸而被激活,从而导致NRF2通过泛素/蛋白酶体途径降解。然后,NRF2的下调抑制了SLC7A11和GPX4的表达,进而促进了肝癌细胞铁死亡。该研究揭示了APE1通过调控AKT/GSK3β/NRF2轴调节肝癌细胞铁死亡的作用机制。总的来说,该研究表明APE1是一个新型铁死亡调控因子,揭示了APE1在调控HCC细胞铁死亡中的新的作用机制,并强调了靶向APE1可作为HCC和其他癌症治疗的一种有前景的策略。南京师范大学生命科学学院已毕业硕士杜雨和2021级硕士研究生周宇为该论文的共同第一作者,胡志刚教授和郭志刚教授为论文共同通讯作者。该研究得到了国家自然科学基金和江苏省高校优势学科建设项目的资助。 www.nature.com/articles/s41418-024-01270-0
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。







发表评论
注册或登后即可发表评论
登录注册
全部评论(0)