2022-05-12

2022年5月5日,Nature 系列综述期刊 Nature Review Drug Discovery 发表了一篇题为:Trends in innovative drug development in China(中国创新药研发趋势)的文章。
这篇文章由中国国家药监局药品审评中心(CDE)、北京大学药学院和北京大学第一医院药学部的研究人员联合撰写,文章对2010年-2020年在中国获批的新药临床试验申请(IND)和新药上市申请(NDA)数据进行了汇总分析。

趋势一:首次申请IND的创新药数量显著增加
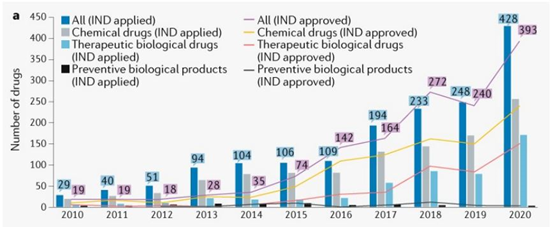
在2010年-2020年期间,共有1636个创新药物递交了首次IND申请,平均年增长率为32%(图1)。其中,1410个(86%)药物来自于689家中国本土公司。值得注意的是,与2016年相比,2017年创新药物的首次IND申请数量增加了78%,其中化学药物和治疗用生物制品分别增加了60%和159%。
在1466个完成审评的首次IND申请中,1404个(96%)获得批准。未获得批准的原因主要包括申请后缺乏研究资料导致沟通不畅、药物临床获益风险比不合理、违反临床诊断基本原则等。统计显示,首次获得IND批准的创新药数量年均增长率为35%,其中2016年首次获得IND批准的创新药数量显著增加。
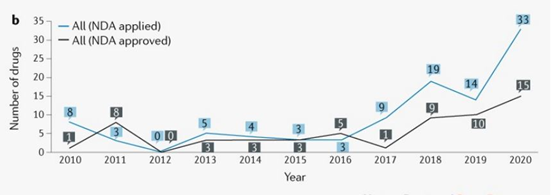
在58个获得批准的创新药物中,37个为中国国家药品监督管理局(NMPA)批准的新分子实体(NME),21个是已在国外获批或上市销售的药物或者传统疫苗、血液制品、细胞因子等产品。从适应症来看,有14个(24%)产品为孤儿药,其中有13个药物符合美国FDA的孤儿药标准。此外,有40个创新药物(69%)获得了优先审评,其中有35个(88%)药物是在2015年7月之后获得批准。文章指出,这些数据表明,包括2015年8月推出的优先审评等改革措施鼓励了创新药的研发进度。
趋势三:肿瘤是主要研究领域,多数抗肿瘤新药处于早期阶段
从疾病领域来看,获得首次IND批准的创新药的主要治疗领域是肿瘤学(864,62%)、感染(166,12%)、内分泌疾病(72,5%)和心血管疾病(60,4%)。值得一提的是,2016年首次获得IND批准的抗肿瘤药物数量显著增加,增长了133%。
从临床试验开发进度来看,在首次获得IND批准的创新药物中,705(50%)个至少进入到了1期临床,286(20%)个药物进入到了2期临床,108(8%)个药物进入到了3期临床。总体而言,大多数抗癌药物(57%)尚处于1期临床阶段(图3a)。
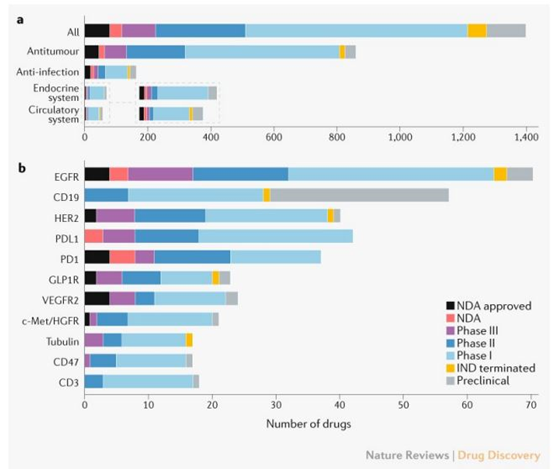
此外,研究人员也对这些药物的作用机制和靶点进行了分析。文章指出,中国主要处于快速跟进和渐进创新的阶段,在已获得NDA批准的创新药中,只有3个是“first-in-class”。从靶点来看,有超过40个药物针对的靶点是EGFR、PD-L1和HER2(图3b)。其中,EGFR靶向药物的获批数量(4个)和临床试验数量(64个)最多。
趋势四:IND和NDA审批速度加快,临床试验速度并无显著差异
如图4所示,与改革前(2010年1月至2015年6月)相比,改革后(2015年7月至2020年12月)的IND审批时间缩短了414天(87天 vs 501天)。与此同时,改革后药品的 NDA审批时间也比改革前缩短了441天(483 vs 924天)。
2018年7月开始,NMPA将药物临床试验审批程序调整为默示许可制度。从整个临床试验阶段的长度而言,改革后和改革前的差异并不显著(2572 vs 2688天)。不过分析发现,就IND批准后到首例受试者参加临床试验的时间而言,改革后比改革前长了59天(328 vs 269天)(见图4)。
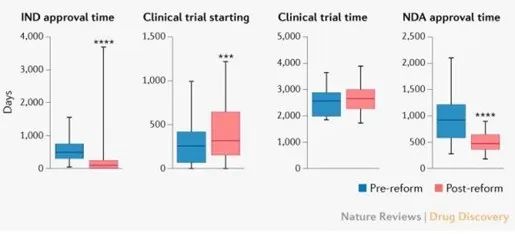
文章指出,提高临床试验效率是中国鼓励创新的一个重要改革方向。由于临床试验效率受到伦理审查效率、研究者经验和临床试验资源等多重因素的影响,因此这个问题需要国家临床试验能力的战略升级来解决。
总结
作者认为,总体而言,中国的监管改革促进了本土医疗创新。2010年–2020年期间获批的IND数量和NDA数量趋势以及审批时间的趋势表明,监管改革带来的效果通常是有益的。文章同时也指出,具有相同靶点的过多产品和低效的临床试验过程将影响真正有意义的创新药物获批。
百度浏览 来源 : 药明康德内容团队
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。




发表评论
注册或登后即可发表评论
登录注册
全部评论(0)