2022-06-09

200多场会议、超过5000篇前沿研究、4万余名肿瘤学专业人士齐聚……肿瘤领域的年度盛会ASCO即将亮相。
每年的ASCO(美国临床肿瘤研究协会年会)都是全球癌症领域最新、最值得关注的研究进展与关键性临床数据大放异彩的舞台。
今年6月3日-7日,2022 ASCO将在美国芝加哥以线上线下的形式举办,2022 ASCO将召开200多场会议,吸引了来自世界各地的4万多名肿瘤学专业人士参加。2022 ASCO中将有超过 5000 篇前沿研究来诠释本届大会主题:通过创新推进公平的癌症护理。
据悉,本次大会会议类型主要分为口头汇报会议、壁报讨论会、壁报展、教育会议、临床科学研讨会等,会议将根据不同疾病主题分为 24 场,包括:乳腺癌,护理服务,中枢神经系统肿瘤,临床试验,免疫疗法,分子靶向药物和肿瘤生物学,胃肠道癌:结直肠癌和肛门癌,胃肠道癌:胃食管癌、胰腺癌和肝胆癌,泌尿生殖系统癌:肾和膀胱,泌尿生殖系统癌:前列腺癌、睾丸癌和阴茎癌,老年肿瘤学,妇科癌症,头颈癌,血液系统恶性肿瘤,免疫疗法,肺癌,黑色素瘤/皮肤癌,儿科肿瘤学,预防、降低风险和遗传性癌症,肉瘤。
从摘要、到壁报展示,再到口头报告,随着中国医药创新研发的全面加速,更多来自中国的药企,有机会将自身的创新成果带到ASCO的舞台。
据西南医药统计,2022年ASCO共有来自中国生物医药公司的119个临床试验项目入选,其中单抗80个,双抗16个,CAR-T 8个,ADC 3个。入选临床试验数量最多的前5家企业为百济神州15项,恒瑞医药12项,信达生物、亚盛医药、石药集团各有7项,入选临床试验数量分别为15、12、7、7、7。入选临床试验涉及靶点数量排名前5的靶点为PD-1/L1、VEGFR、HER2、EGFR、CTLA-4,数量分别为33、13、12、8、6。
据E药经理人不完全统计,将有12篇来自中国生物医药公司的,针对不同疾病的临床研究进展报告摘要入选大会口头报告环节。
在12项口头报告中,围绕PD-1单抗的研究依然是焦点,有5项为PD-1类产品的报告。
其中,复宏汉霖将发布斯鲁利单抗用于治疗一线小细胞肺癌的III期临床试验数据;基石药业将汇报舒格利单抗复发或难治性结外自然杀伤/T细胞淋巴瘤(R/RENKTL)的II期临床试验数据。
百济、信达、恒瑞,这三家当前中国PD-1适应证拓展最快的三家公司也将报告其PD-1产品用于治疗多癌种的临床数据。
百济神州将在6月3日汇报替雷利珠单抗的一项开放标签、单臂II期TRUCE-02研究评估替雷利珠单抗联合白蛋白结合型紫杉醇治疗高危非肌层浸润性尿路上皮膀胱癌。
此前,替雷利珠单抗此前已在中国获批8个适应证。今年4月,替雷利珠单抗获批在中国的第8项适应证,用于治疗既往接受过一线标准化疗后进展或不可耐受的局部晚期或转移性食管鳞状细胞癌(ESCC)患者。此前,替雷利珠单抗已在中国获批7项适应症,其中包括完全批准用于:联合化疗用于治疗一线晚期鳞状非小细胞肺癌(NSCLC)患者;联合化疗用于治疗一线晚期非鳞状NSCLC患者;治疗既往接受含铂化疗后出现疾病进展的二线或三线局部晚期或转移性NSCLC患者。以及附条件批准用于:治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤(cHL)患者;PD-L1高表达的含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性尿路上皮癌(UC)患者;至少经过一种全身治疗的肝细胞癌(HCC)患者;不可切除或转移性微卫星高度不稳定型(MSI-H)或错配修复基因缺陷型(dMMR)的成人晚期实体瘤患者。资料显示,百济神州已在全球35个国家和地区开展或完成了超过20项替雷利珠单抗的注册性临床试验。
今年5月12日,恒瑞曾对外披露,其创新药“双艾”方案(注射用卡瑞利珠单抗艾瑞卡联合甲磺酸阿帕替尼片艾坦)的国际多中心Ⅲ期临床试验(SHR-1210-Ⅲ-310)由美国独立数据监察委员会(IDMC)判定主要研究终点结果达到方案预设的优效标准。
卡瑞利珠单抗是恒瑞医药研发的PD-1单抗,阿帕替尼为恒瑞医药研发的VEGFR-2酪氨酸激酶抑制剂,两款产品均已在中国获批上市,恒瑞此前公告显示,“双艾”方案是恒瑞推进开展的首个国际多中心III期临床研究。该项研究是一项评估卡瑞利珠单抗联合阿帕替尼对比索拉非尼,治疗既往未接受过系统治疗的,不可切除或转移性肝细胞癌患者有效性和安全性的随机对照、开放性、国际多中心III期临床研究。
此外,该药目前还有超过20个临床研究正在进行中,其中十余项为注册临床试验。
舒格利单抗治疗复发或难治性结外自然杀伤细胞/T细胞淋巴瘤(R/R ENKTL)患者的单臂、多中心2期GEMSTONE-201研究的预设主要分析结果入选口头报告。
舒格利单抗是基石药业研发的抗PD-L1抗体,已经在中国一线治疗转移性鳞状和非鳞状非小细胞肺癌适应症。根据基石药业新闻稿,GEMSTONE-201研究已于2022年1月经独立影像评估委员会(IRRC)评估,达到预设的主要研究终点,是首个在R/R ENKTL患者中取得成功的PD-1/L1抑制剂注册性临床研究。根据该研究的初步有效性结果,针对R/R ENKTL适应症,舒格利单抗已经被FDA授予孤儿药资格和突破性疗法认定,并被CDE纳入突破性治疗品种。
附:参与2022 ASCO中国生物医药企业的口头汇报项目
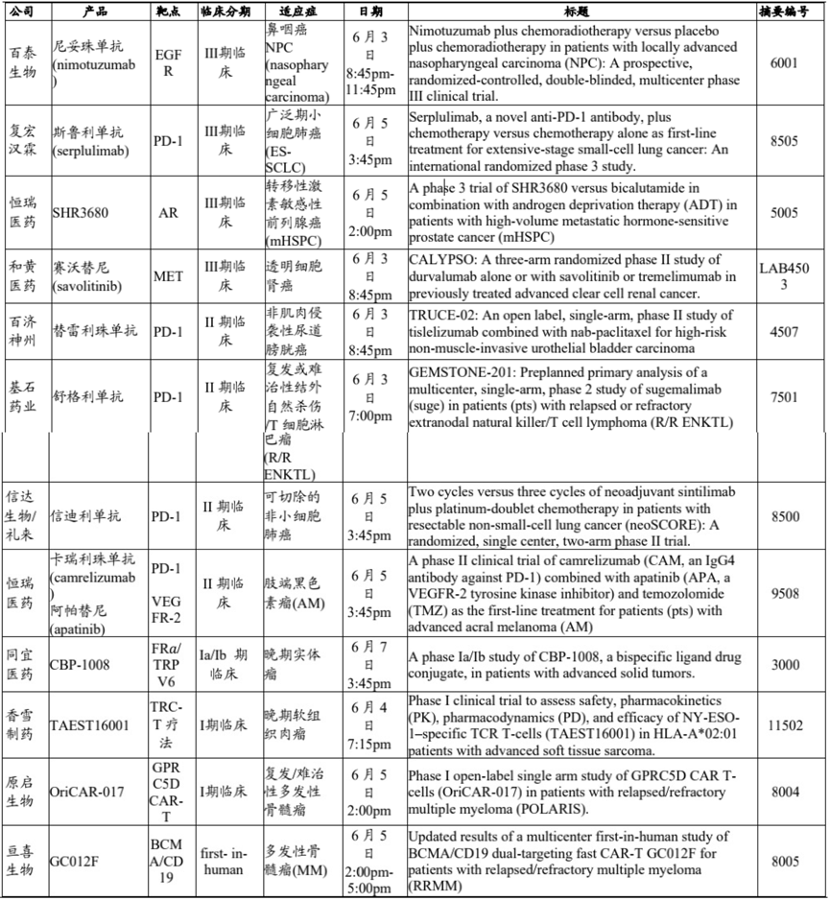
图源丨兴业证券经济与金融研究院整理
参考资料:
1.2022 ASCO官网
2.招商证券《中国医药、医疗行业2022 ASCO会议预告更新》
3.兴业证券《2022 年度 ASCO 部分中国公司汇报梳理》
4.各公司新闻稿
百度浏览 来源 : E药经理人
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。




发表评论
注册或登后即可发表评论
登录注册
全部评论(0)