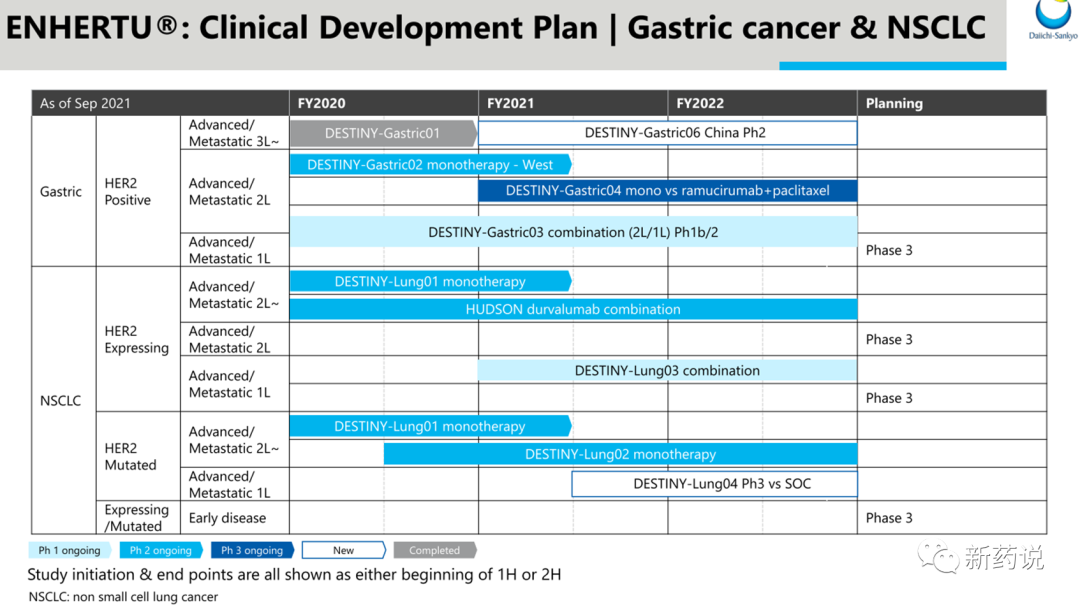
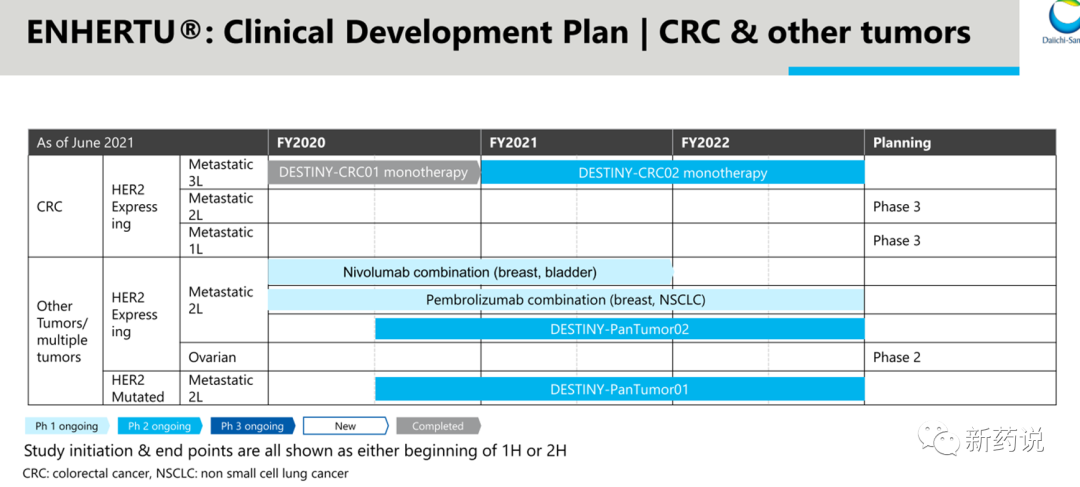
2021年12月第一三共公布的后续对DS-8201临床的开发策略,癌种涵盖乳腺癌、胃癌、非小细胞肺癌、结直肠癌以及其他HER2表达或突变的实体瘤。而在乳腺癌、胃癌、非小细胞肺癌上,均有将其提至一线的计划。目前DS-8201完全获批了两项适应症,第一项适应症为至少接受过两种及以上治疗得Her2阳性不可切除或转移乳腺癌患者,此获批是基于一项多中心、单臂II期DESTINY-Breast01研究,接受DS-8201 5.4mg/kg治疗得184例患者中,中位治疗线数为6线,ORR(客观缓解率)达60.3%(n=111);其中4.3%(n=8)的患者达到CR(完全缓解);56%(n=103)的患者达到PR(部分缓解)。另外,mDoR(中位缓解持续时间)为14.8个月,mPFS为16.4个月,值得一提的是,这些患者此前均接受过T-DM1治疗。安全性方面,3级以上不良反应为52.2%,9%的患者出现了严重间质性肺炎 (ILD),其中2.6%的患者因ILD死亡,FDA黑框警告中特意提到了ILD以及胚胎毒性。第二项适应症胃癌的获批则是基于一项与化疗头对头II期DESTINY-Gastric01研究,先前至少接受过两种标准治疗进展的187名胃癌患者,6.4mg/kg的DS-8201实现了43%的ORR,其中CR为8%,而对照组中传统化疗组的ORR则仅有12%,无CR;mOS为12.5个月,相比化药组8.4个月的OS延长了48.8%;mPFS则达5.6个月,明显优于传统疗法的3.5个月。安全性方面,3级以上不良反应发生率为44%,包含发热性中性粒细胞减少、贫血、恶心,2.5%的患者出现了3级及以上间质性肺病事件。2022年4月20日,阿斯利康和第一三共联合宣布,双方联合开发的Enhertu的补充生物制品许可申请(sBLA)已经获得美国FDA授予的优先审评资格,用于二线治疗携带HER2突变的不可切除或转移性非小细胞肺癌(NSCLC)患者。第三项适应症非小细胞肺癌(NSCLC)的sBLA是基于一项多中心、单臂II期DESTINY-Lung01研究,在HER2突变的,曾经接受过一种全身性治疗的91名不可切除或转移性NSCLC患者中,6.4mg/kg的DS-8201实现了55%的ORR(客观缓解率),其中包含1例CR(完全缓解),疾病控制率达到92%。另外,mDoR(中位缓解持续时间)为9.3个月,mPFS(中位无进展生存期)为8.2个月,mOS
(中位总生存期)为17.8个月。安全性方面,3级以上不良反应为46%,常见3级以上不良反应为中性粒细胞减少(19%)和贫血(10%);另外有2例因间质性肺炎 (ILD)引起的死亡,ILD总发生率为26.4%,其中3级以上ILD的发生率为6.6%。2022年6月,DS-8201亮相2022
ASCO大会,在HER-2低表达乳腺癌人群中展示了优异的治疗效果,此为一项名为DESTINY-Breast04的研究,招募了557例先前中位治疗线数为3的HER2低表达患者,在占比88.7%的HR+人群中,5.4
mg/kg DS-8201实现了52.6%的ORR,而对照组中传统化疗组的ORR则仅有16.3%;mPFS为10.1个月,相比化药组5.4个月的OS延长了快一倍;mOS则达23.9个月,明显优于传统疗法的17.5个月;在另外11.3%的HR-人群中,DS-8201组和化疗组的ORR分别为50.0%和16.7%,mPFS分别为8.5个月和2.9个月,mOS分别为18.2个月和8.3个月。安全性方面,3级以上不良反应发生率为52.6%,2.1%的患者出现了3级及以上间质性肺病事件。在讨论DS-8201成功的时候,大家把目光都投向了linker-payload,可裂解的酶切linker,
payload适当的毒性以及by stander效应确实功不可没,但为什么就DS-8201一枝独秀的闪耀,一样平台做出来的DS-1062、U3-1402的水花并没有到处飞溅呢?这里就不得不说说her2这个可遇不可求的靶点了,对ADC来说,它的作用机理决定了抗体端起到靶向作用、能内吞入胞就可以,我们并不关心单抗本身它是不是有药效,Fc端的ADCC、CDC功能也不重要,这也就是为什么之前的FRa、NECTIN-4、trop2等一众靶点单抗没有临床药效,但做成ADC之后就盘活了这个靶点一样。所以,这个角度看,像Her2这种单抗有效的本身算是锦上添花。另外,也是最关键的地方在于,我们看看对HER2-Low
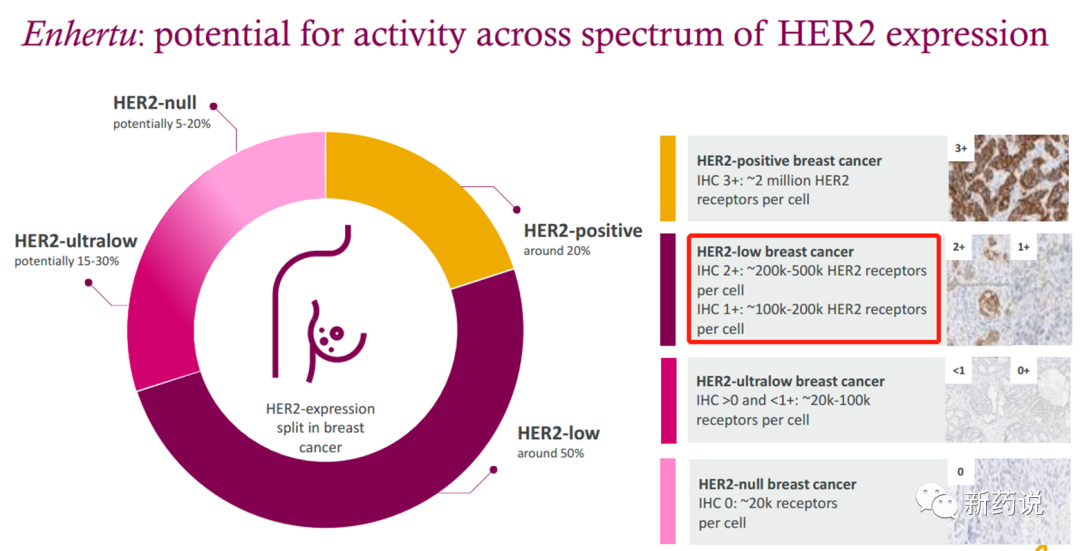
breast cancer的定义,IHC1+的表达也有10的5次方/cell(来源:阿斯利康 2022
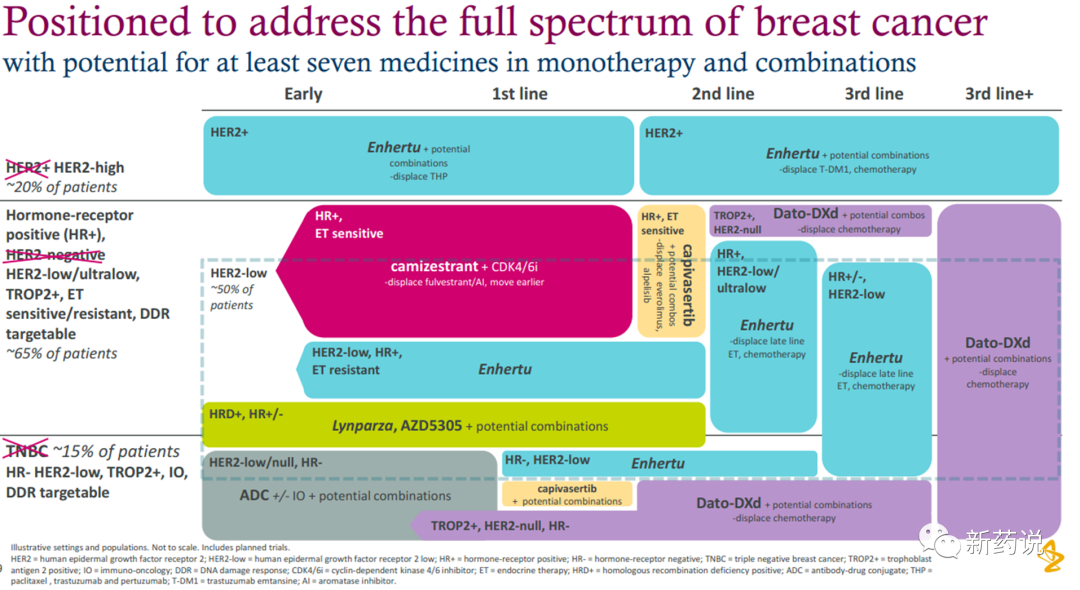
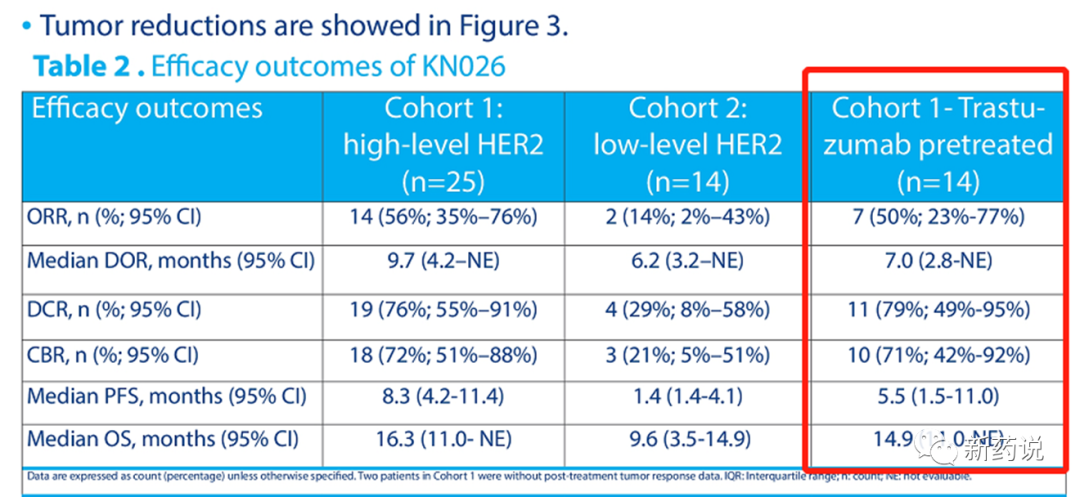
ASCO PPT),这个水平,换个靶点,分分钟都能称为高表达。这一点上,Her2高调地证明了一句话叫做“瘦死的骆驼比马大”。而第一三共在这件事情上做的最好的决定是,慧眼识珠,开发了Her2这个靶点。“知己知彼,百战不殆”,第一三共/阿斯利康的临床设计,是深知自己的优势的。下面这张图对乳腺癌市场的规划非常清晰了,专业的药治擅长的病。乳腺癌上,目前以及未来DS-8201不能触及的领域为her2(IHC1+,2+)低表达3线以上的用药,以及TNBC的领域,这部分便是Trop2、Her3、Liv1等一众靶点发挥的空间。胃癌上,我们把目光投向国内,在此我用康宁杰瑞的KN026举例。肿瘤领域,ADC技术逐渐成熟以后,双抗想做出比ADC更好的药效太难了,KN026也在此次ASCO大会上公布了最新的数据,标出红框的这一栏尤其值得关注,在之前接受过曲妥珠治疗的her2高表达胃癌患者中,KN026实现了50%的ORR,mPFS
5.5个月,mOS 14.9个月,3级以上不良反应发生率为11%。这组数据,相比43%的ORR,5.6个月的 mPFS ,12.5个月的mOS以及44%
3级以上不良反应的DS-8201,如果后面扩大人数后还能重复出来,加上它的安全性,胃癌适应症上的优势还是明显优于DS-8201的。以上两个适应症,我们讨论的都是同适应症Her2靶点以外的空间,我们把目光拉回Her2本身,抗体相差不多的情况下,linker-payload大改,有可能突破DS-8201吗?荣昌生物RC48
ADC在尿路上皮癌上的数据或许能给我们一些启示。2022年2月17日,荣昌生物公布了RC48
ADC联合疗法治疗局部晚期或转移性尿路上皮癌的最新临床进展。在治疗局部晚期或转移性尿路上皮癌的1b/2期临床研究(RC48-C014)中,RC48联用PD-1单抗,在HER2(3+)患者的ORR高达100%,在先前未治疗的一线mUC患者的ORR为80%,在所有患者中,经证实的研究者评估的ORR为75%。对比DS-8201联合O药治疗mUC的结果,在HER2
IHC 2+/3+阳性患者中,ORR为36.7%,其中CR为13.3%,mDOR为13.1个月,mPFS为6.9个月,mOS为11.0个月。mUC适应症上,RC48 ADC数据秒杀DS-8201。另外,mUC的领域,Seagen算是紧紧的握在了自家手里,合作开发的RC48
ADC开发一线疗法,而自家已上市的Nectin
ADC-Padcev则掌握了二线治疗mUC的主动权。肿瘤是一个太过复杂和庞大的领域,DS-8201的成功对做药人来说,应该是一针兴奋剂,见贤思齐,而非“妄自菲薄”,肿瘤只要一日未治愈,每一个做药企业都空间无限。
参考文献:
[1]Modi, Shanu, Saura, , et al.
Trastuzumab Deruxtecan in Previously Treated HER2-Positive Breast Cancer.
[2] Shitara K ,Bang Y J , Iwasa S , et al. Trastuzumab Deruxtecan in Previously Treated
HER2-Positive Gastric Cancer[J]. New England Journal of Medicine, 2020,
382(25).
[3] Trastuzumab Deruxtecan in HER2-Mutant
Non–Small-Cell Lung Cancer.The New England Journal
of Medicine, 2022.
[4] Trastuzumab Deruxtecan in Previously
Treated HER2-Low Advanced Breast Cancer.The
New England Journal of Medicine, 2022.
[5] 2022 ASCO.






发表评论
注册或登后即可发表评论
登录注册
全部评论(0)