2022-07-18 来源 : Hanson临床科研
导言:

1,免疫逃逸是Omicron取代Delta的关键原因
香港大学文章的题目是“Pathogenicity, transmissibility, and fitness of SARS-CoV-2 Omicron in Syrian hamsters”,报道了在仓鼠模型中,Delta和Omicron两种突变株体内的病毒毒力、传播能力及病毒适应性(fitness)的差异【1】。
这篇文章与之前两篇Nature文章的结论一致。仓鼠是研究SARS-CoV-2的最好体内模型之一,因为仓鼠感染病毒后的病理变化和疾病进展与人类似。
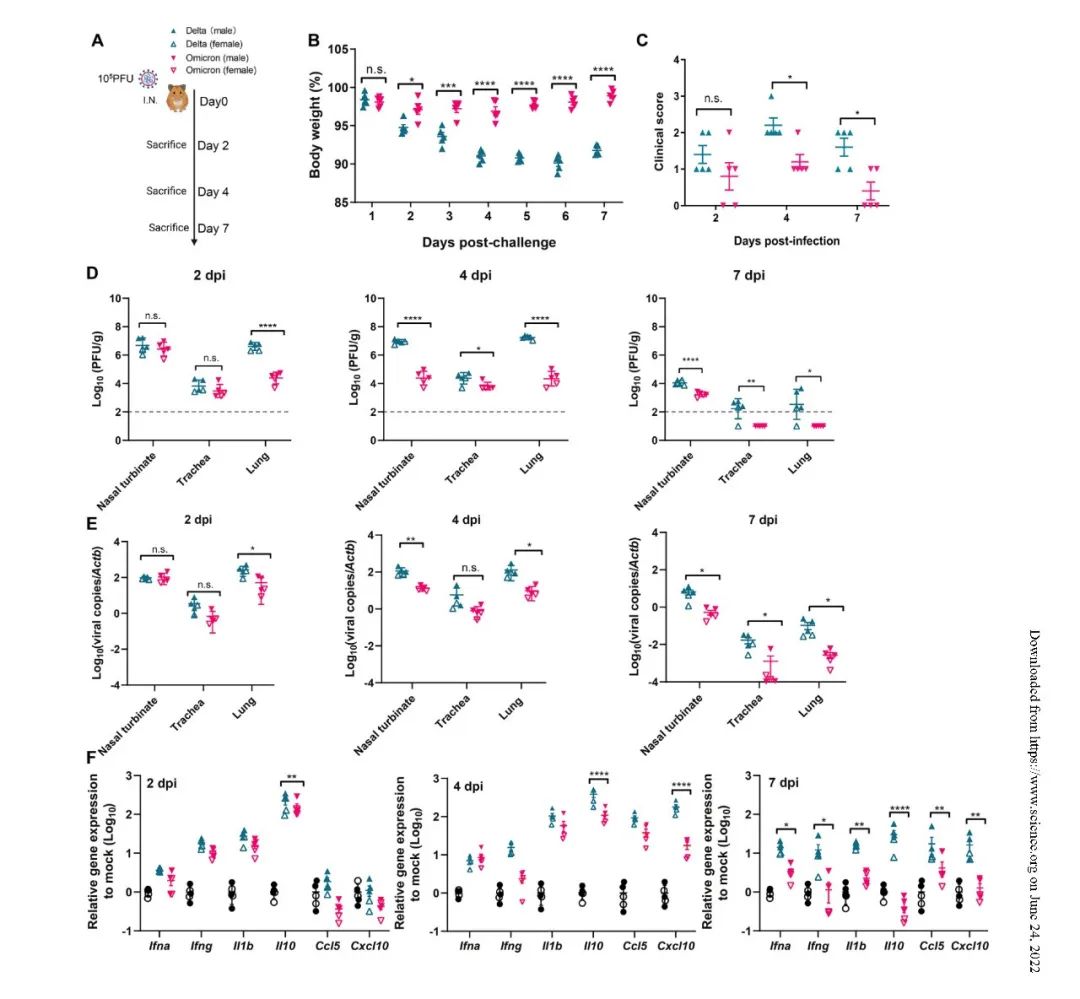
研究发现与感染Delta的仓鼠相比,Omicron感染后的仓鼠没有明显的体重减轻,其临床评分显示临床表现轻微,呼吸道病毒载量显著降低,而且炎症细胞因子和趋化因子的失调并不严重,因此肺损伤十分轻微。
然而,Delta和Omicron两种突变株都具有很高的传播能力,在没有免疫选择压力的情况下(即没有明显免疫逃逸的情况下),Delta的传播能力超过了Omicron;一旦引入了免疫选择压力,那么中和抗体对Delta的抑制作用明显,但对Omicron缺乏抑制作用很差,这一特征造成了Omicron能够迅速取代Delta。
因此,免疫逃逸是Omicron取代Delta的关键原因。
2,Omicron突变株嗜肺性降低
来自牛津大学十分重要的研究论文题目是“Pathogen-sugar interactions revealed by universal saturation transfer analysis”,一定程度解释了目前的新型冠状病毒SARS-CoV-2突变株嗜肺性降低原因【2】。
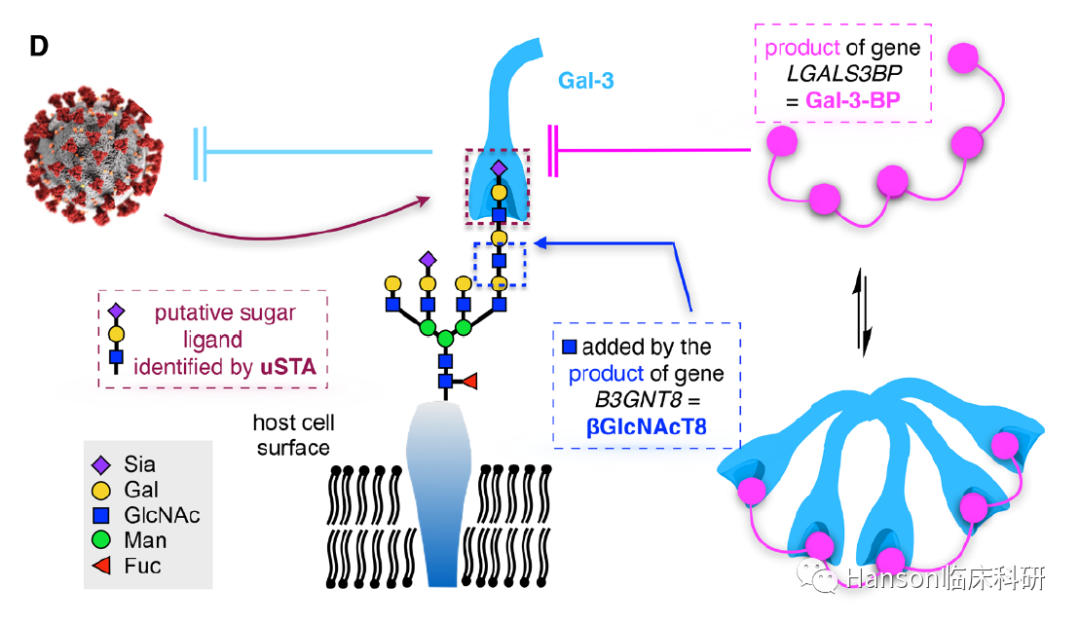
这项研究首先介绍了研究病原体糖基化的重要技术“通用饱和转移分析”(uSTA),它以现有的核磁共振光谱为基础,应用高通量自动化技术定量蛋白-配体相互作用。uSTA揭示了SARS-CoV-2早期B谱系SARS-CoV-2 Spike三聚体以其NTD结合唾液苷糖。Cryo-EM验证了Spike NTD与唾液苷糖的结合(2.3A)。
有趣的是,目前流行的突变株Omicron等其NTD发生的突变(H69/V70/Y145)使其与唾液苷糖结合减弱或者消失。
而人肺泡细胞的N-连接糖蛋白上具有唾液酸化聚乳糖胺基序(Sia-Gal-GlcNAc motifs,N-linked-polyLacNAc-chains)与突变后的病毒NTD不能有效结合,可能是Omicron等突变株嗜肺性降低,从而毒力下降的重要原因;但却也同时使新的突变株具有“减少中和抗体结合及被清除”的潜力,从而更具适应性。

版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)