新出炉的重要法规,新鲜快递到手,
附上独家伴随解说
法规速递
(07月13日-07月19日)

一、NMPA
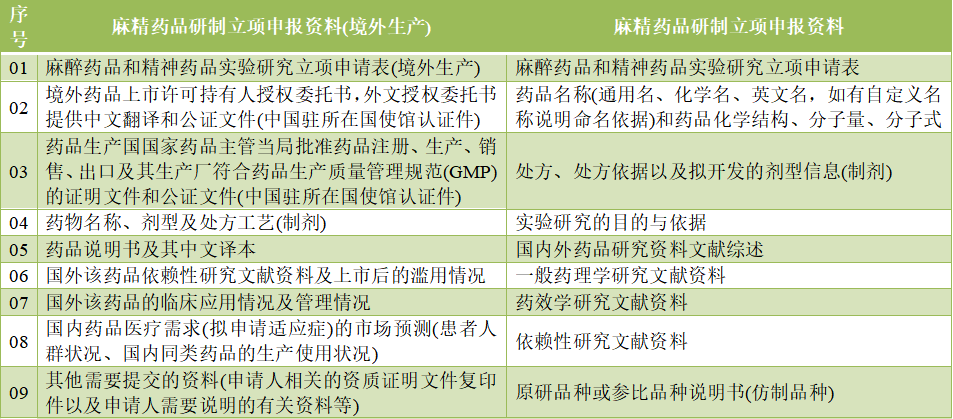
01关于启用麻醉药品和精神药品实验研究活动审批模块的通告
发布时间:2022-07-14
概述:NMPA于药品业务应用系统——“麻醉药品和精神药品实验研究活动审批模块”自通告发布之日起正式启用,用于办理麻醉药品和精神药品实验研究的申请、受理、审批等业务。申请单位可以登录“国家药品监督管理局网上办事大厅”提出麻醉药品和精神药品实验研究申请,同时报送纸质材料1份,申报资料目录如下。

02关于批准注册193个医疗器械产品公告(2022年6月)
发布时间:2022-07-15
概述:2022年6月,NMPA共批准注册医疗器械产品193个。其中,境内第三类医疗器械产品139个,进口第三类医疗器械产品26个,进口第二类医疗器械产品25个,港澳台医疗器械产品3个。
二、CDE
01关于公开征求《申办者临床试验期间安全性评价和安全性报告技术指导原则(征求意见稿)》意见的通知
发布时间:2022-07-13
结束时间:2022-08-13
概述:临床试验期间的安全性评价包括个例安全性报告(ICSR)的评价和安全性数据的汇总分析评价。ICSR是描述临床试验中个体受试者发生的不良事件信息的报告。临床试验期间,申办者对ICSR特别是对严重不良事件(SAE)进行审查,对了解试验药物的基本安全性特征并及时采取有效的风险控制措施具有较大的意义。安全性数据的汇总分析是通过定期对试验药物所有已完成和正在进行的临床试验的安全性数据(包括ICSR)及其他相关安全性信息进行综合分析,以持续动态进行安全性信息的监测和评估。汇总分析结果的报告可以总结报告的形式体现。总结报告应包括对ICSR的评价,并列出汇总分析所使用的所有ICSR。如果ICSR已报告SUSAR,则需列出其全球唯一病例识别码。汇总分析报告内容应至少包括:1、病例信息及可疑严重不良反应的描述。2、汇总分析方法和结果的描述。
02关于公开征求《药物临床试验期间安全性数据快速报告常见问答(2.0版)》意见的通知
发布时间:2022-07-19
截止时间:2022-08-02
概述:申请人获准开展药物临床试验后,对于临床试验期间发生的(包括中国境内和境外)所有与试验药物肯定相关或可疑的非预期严重不良反应,以及《药物临床试验期间安全性数据快速报告的标准和程序》规定的其它情形,都应按照标准和程序在规定的时限内向国家药品审评机构进行快速报告。2.0版问答对快速报告范围、快速报告时限、快速报告方式、快速报告主体、账号管理及测试问题等多方面常见问题做出解答。
三、国采办
01第七批集采中选结果正式公布
发布时间:2022-07-18
概述:上海阳光医药采购网国家组织药品联合采购办公室下发第七批集采中选结果正式公布。此次集采共有295家企业的488个产品参与投标,217家企业的327个产品获得拟中选资格,最终有60种药品采购成功,拟中选药品平均降价48%。相比7月12日开标当天即公布的拟中选企业名单,正式的中选结果公布了每个品种每家中选企业的供应省份和备供省份。本次集采中选结果将于2022年11月实施,具体执行日期以各地发布通知为准。
四、NIFDC
01 2022年医疗器械分类界定结果汇总
发布时间:2022-07-13
概述:中检院发布“2022年医疗器械分类界定结果汇总”。本次汇总的2022年1月-2022年6月医疗器械产品分类界定结果共369个,其中建议按照Ⅲ类医疗器械管理的产品106个,建议按照Ⅱ类医疗器械管理的产品108个,建议按照I类医疗器械管理的产品90个,建议不单独作为医疗器械管理的产品30个,建议不作为医疗器械管理的产品29个,建议按照药械组合产品判定程序界定管理属性的产品1个,建议视具体情况而定的产品1个。
五、ChPC
01关于征求《中国药典》药品包装用橡胶密封件3个通则意见和8个通用检测方法草案意见的通知
发布时间:2022-07-13
截止时间:2022-08-13
概述:药典委征求《中国药典》药品包装用橡胶密封件3个通则意见和8个通用检测方法草案意见。通则草案包括:5200药品包装用橡胶密封件征求意见稿;5201注射剂包装用橡胶密封件征求意见稿;5202口服制剂包装用橡胶密封件征求意见稿。通用检测方法草案包括:4204药包材溶出物测定法;4206药包材不溶性微粒测定法;4214药包材金属元素、金属离子测定法;4219橡胶密封件挥发性硫化物检查法;4220橡胶密封件灰分测定法;4221橡胶密封件水分测定法;4222橡胶密封件表面硅油量测定法;4223硅橡胶密封件特定残留物测定法。
六、广东省局
01关于印发《广东省药品监督管理局药物非临床安全性评价研究机构和药物临床试验机构监督管理细则》的通知
发布时间:2022-07-14
概述:《广东省药品监督管理局药物非临床安全性评价研究机构和药物临床试验机构监督管理细则》共五章(总则、基本要求、监督检查、检查人员管理、附则),二十五条,现予印发,自2022年8月1日起实施,有效期5年。细则适用于广东省局对本行政区域内通过药物非临床研究质量管理规范认证的研究机构和取得备案号的试验机构的监督管理,内容包括GLP和GCP机构的备案,年度报告,以及监督检查要求。
七、北京医保局
01关于印发CHS-DRG付费新药新技术除外支付管理办法的通知(试行)
发布时间:2022-07-13
概述:北京医保局发布《关于印发CHS-DRG付费新药新技术除外支付管理办法的通知(试行)》,进一步完善北京市疾病诊断相关分组(CHS-DRG)付费工作,于2022年7月20日至8月19日期间开展2022年CHS-DRG付费新药新技术除外支付申报工作。其中药品及医疗器械申报范围如下:
同时满足以下条件的药品及医疗器械由企业向北京市医保中心申报:1.三年内(指含申报年度及之前的两个自然年度)经药监部门批准上市的新通用名药品/医疗器械;三年内因增加功能主治或适应症发生重大变化的药品;三年内新纳入国家医保药品目录的药品;三年内由于价格调整新增的可另行收费的医疗器械。2.取得国家医疗保障局医保药品分类与代码/医保医用耗材分类与代码。3.符合相关价格政策规定。4.临床效果较传统药品/医疗器械有较大提升。5.对DRG病组支付标准有较大影响。6.全市累计基本医疗保险参保人员病例达到50例以上,罕见病不受例数限制。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)