2022-08-05 来源 : 招财小黄鸭 ,作者黄老师

信达生物二季度:
pd1方面,礼来披露Tyvyt
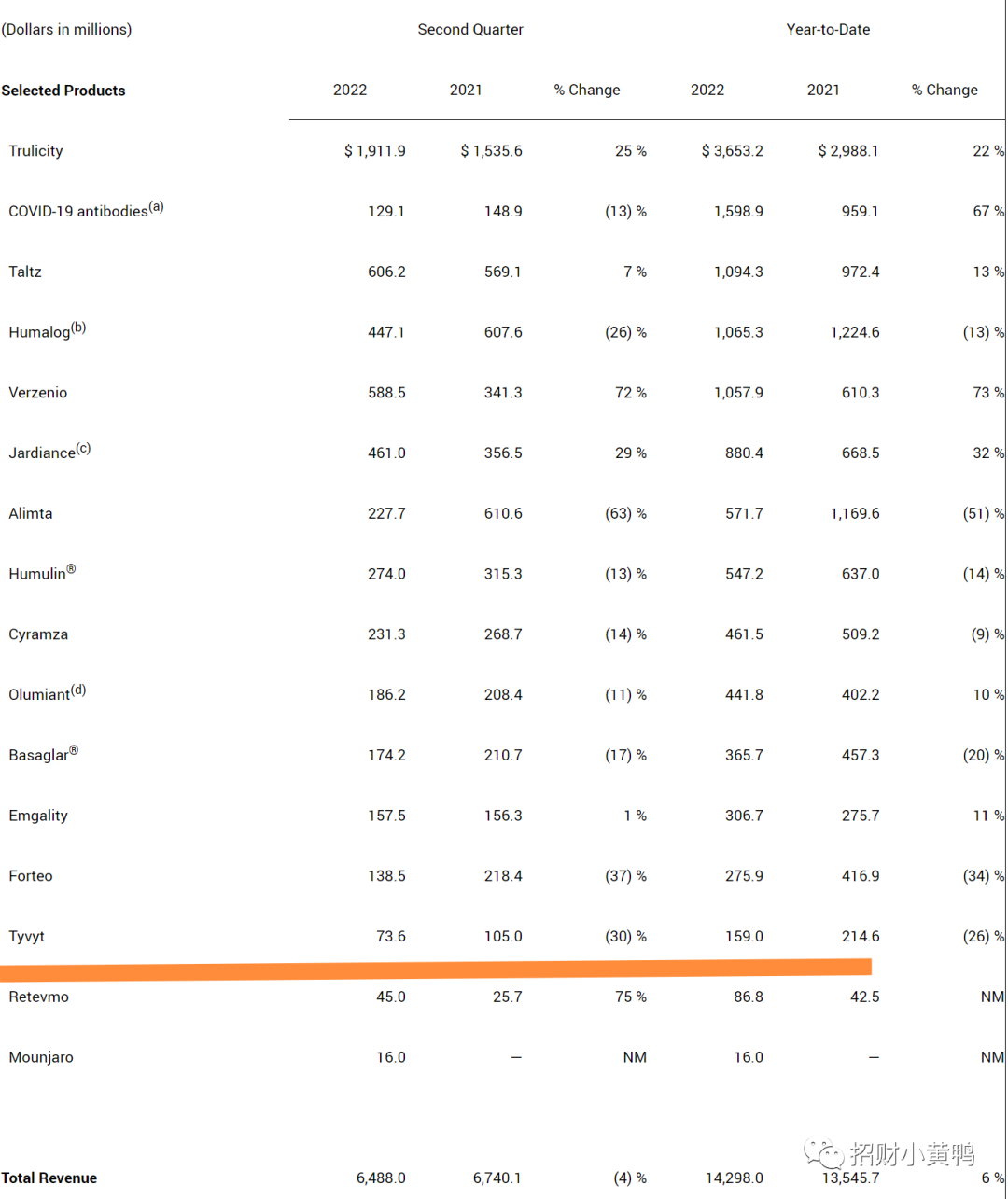
总产品收入方面,信达生物公布,取得收入超人民币10亿元。已获批商业化产品组合持续放量增长。
截至2022年第二季度,信达已取得七款产品获批。首席商务官刘敏可能要离职。负责公司业务运营,包括市场,销售,市场准入等。武汉大学生物化学专业学士,美国哈佛商学院MBA。曾先后担任罗氏中国肿瘤事业部及普药事业部副总裁,爱尔康北中国总经理,优时比销售总监和阿斯利康市场总监等职位。拥有跨国医药公司超过20年的业务管理、战略决策、团队发展等丰富经验。

百济神州二季度:
2022年上半年,百泽安在国内市场销售额达到了1.925亿美元,同比增长55.6%。
第二季度,百泽安在中国的销售额为1.049亿美元,上一年同期数据为7,490万美元,增长40%。在当前PD-1领域白热化的市场竞争中,这一增长表现可谓不俗。
上半年,百泽安在国内新增获批3项适应症:一线复发或转移性鼻咽癌(NPC)、二线食管鳞状细胞癌,以及不可切除或转移性微卫星高度不稳定型(MSI-H)或错配修复缺陷型(dMMR)的晚期实体瘤,目前9项适应症成为国内市场上获批治疗适应症最多的抗PD-1单抗。另有一项NDA已获得CDE受理:联合化疗,用于表达PD-L1的晚期或转移性胃或胃食管结合部(G/GEJ)腺癌患者的一线治疗。
5项适应症已纳入2021年国家医保目录,也是国内纳入医保适应症最多的PD-1产品。
虽然是国内第7款上市的PD-1/PD-L1产品,在上市初期处于后发地位,但凭借其优质的产品治疗潜力,百泽安在主要适应症上奋起直追,在适应症拓展、商业化放量表现上,成为当之无愧的“后起之秀”,展现出强大的市场竞争力。
而在全球化的“出海路径”上,百泽安的布局亦处于领先地位,目前已陆续在多个国家递交上市申请并获得受理。
其中在美国,百泽安用于治疗二线食管鳞癌(ESCC)向FDA递交的首次申报正在审评中;在欧洲,用于非小细胞肺癌(NSCLC)和二线ESCC的上市申请已获得EMA受理;在英国,百泽安用于治疗一线、二线NSCLC和二线ESCC的新药上市申请已获英国药品与保健品管理局(MHRA)受理;此外,在澳大利亚,百泽安用于一线、二线NSCLC和二线ESCC的新药上市申请已经获得澳大利亚药品监督管理局(TGA)受理。

版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)