从机制上来看,可能部分原因在于HBV长期感染刺激下,PD-1和CTLA-4等免疫检查点受体表达量很高,单一免疫靶点单抗药物治疗效果有限。这也是为何O+Y和D+T能在晚期HCC 二线和一线研究都有效果的原因吧。那国内的康方生物的AK104(PD-1/CTLA-4双抗)联合仑伐替尼,康宁杰瑞KN046(PD-L1/CTLA-4双抗)联合仑伐替尼,在晚期HCC一线的探索结果也都不错,似乎圆满解释了这一点。MSD和Eisai昨日宣布,MSD的帕博利珠单抗与Eisai的仑伐替尼联合方案对比仑伐替尼单药方案用于不可切除肝细胞癌的III期研究,LEAP-002,虽然接受帕博利珠单抗加仑伐替尼与仑伐替尼单药治疗的患者的OS和PFS有改善的趋势;然而,这些结果不符合预先规定的统计计划的统计显著性。即未达到总生存率(OS)和无进展生存率(PFS)的双重主要终点。很可惜的一个结果,毕竟是全球多中心的大III期研究,MSD公司本身所具有的临床试验突破能力也让人很佩服。相较于全球K药的市场销量的不断增长,与MSD强大的临床布局能力是密不可分的。但创新药的研究,成功者少,失败者多。尤其是在日益精准多途径综合治疗肿瘤的当下,任何一项推进的III期研究,最大的隐忧在于周期过长,临床实际治疗现状已经改善很多,对照组出组患者接受新的标准方案的比例增高。特别是近年来发展迅猛的ICIs,无论是FDA还是CDE,整个行业的监管环境在日趋严格,想要在OS上做出差异性,着实考量产品的能打性。昨天看到LEAP-002研究的失利,虽然一定程度上与HBV感染导致的HCC入组的患者比例低有关。该结论来源于一篇发表在Nature 上的研究报道,研究团队对CheckMate-459、KEYNOTE-240和IMbrave150三项肝癌临床试验数据进行了分析,结果显示,HBV和HCV感染所致的肝癌患者,在三项研究中,免疫治疗后都有明确的总生存期(OS)获益(HR=0.64),但非病毒性肝炎所导致的肝癌,获益并不明显。进一步的队列分析发现, NAFLD成因的HCC患者接受免疫治疗后总生存期更短,另外一项118位HCC患者(11人患有NAFLD)的队列数据也是如此,合并NAFLD的患者OS远低于不合并患者。由此可之,合并脂肪肝的HCC患者,抗PD-1单抗治疗后,效果远低于病毒性HCC患者。虽然从荟萃分析及机制探讨上,似乎证明病因不同的HCC患者对于免疫治疗的获益是不同的。但《Nature》的研究结果是否靠得住,顶级期刊《新英格兰医学杂志》在2021年7月发表了针对性的评论文章,指出:《Nature》的这项研究提出了新的关键性问题。然而,现有研究结果也并不完全一致。有研究显示,接受纳武利尤单抗和帕博利珠单抗的非病毒性HCC患者,他们的ORR与病毒性HCC患者相似,~20%的非病毒性HCC患者出现深度且持续的缓解。另有帕博利珠单抗以及阿替利珠单抗+贝伐珠单抗的随机临床试验,亚组分析显示非病毒性和病毒性HCC患者的PFS改善趋势相似。meta分析存在其局限性,包括:“非病毒”亚组的异质性,缺乏根据HCC病因进行分层,一线和后线治疗方案的可变性等,这些都可能导致预后评估的不平衡以及混淆。但不可否认的是,未来针对不同病因导致的HCC患者,在研究或临床中如何精准的分层和治疗方案的选择,是有待进一步研究的。鉴于脂肪肝等非病毒感染导致的肝脏损害的研究,应该是迫在眉睫的。既然以上的结论尚处于争议阶段,那我们寻求已有的真实世界的数据,去思索K药联合仑伐替尼的疗效。解放军总医院第五医学中心与北京协和医院两大中心针对仑伐替尼联合免疫治疗进行了一个大队列真实世界研究(n=378),发表于2022年ASCO会议上。- 肿瘤要求:临床诊断或病理学诊断的不可切除肝细胞癌;
- 治疗要求:至少接受过一个疗程仑伐替尼联合抗PD-1抗体治疗.
- 次要研究终点:无进展生存期PFS、客观缓解率ORR、疾病控制率DCR;安全性指标AE.
- 肿瘤分期:BCLC-B期的患者12.7%,C期的患者87.3%;
- 体能评分特点:ECOG 0分(43.7%),1分(43.4%),2分(13.0%);
- 肝功特点:Child-Pugh A级(77.5%),B级(22.5%)。
值得探索的是,从下面的生存曲线来看,帕博利珠单抗组的OS与其他组的OS目前没有差异。三百多例患者的真实世界的数据,mOS达到17.8m,从亚组数据来看,帕博利珠单抗组的OS与其他组的OS目前没有差异。可以看出,相较于T+A中国亚组患者的mOS为24m,还是有差距的。当然,真实世界的数据,一般都是要低于临床试验展示出的数据的。但也侧方面展示出,很多临床研究中的优效性数据,在真实世界中并不一定能重复。但鉴于亚组样本量以及真实世界中各种混杂因素的干扰,药物疗效的差异还需要前瞻性大队列进行进一步验证分析。
这一次,Leap002研究的失利,则意味着,对照组仑伐替尼单药患者进展后再采用免疫方案,基于这个真实世界的数据来看,可能效果差不太多,进一步增加了Leap002优效性的难度。K药的大III期临床研究失利,也让人想起O药单药在HCC领域大III期的失利。
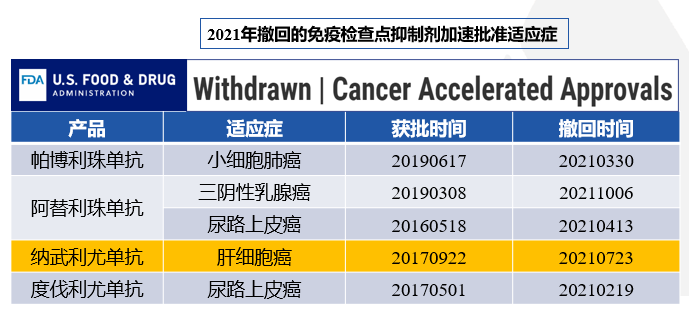
肝癌领域,CM040、KN224为II期试验,基于当时的单臂研究加速批准,只在美国获批,在随后的 CM459和KN240,虽趋势向好,但没有达到统计学差异的预设值,失败告终。目前,保留了K药二线适应症,否决了O药的二线适应症。而更为诛心的是,IMBRAVE150的横空出世,也让FDA否决了可乐组合(帕博利珠单抗联合仑伐替尼)在晚期IL肝癌领域的加速审批通道,可乐组合的LEAP-002 III期研究蒙上阴影。这是对K药的重磅打击。而O药走的更命运多舛,基于II期研究的漂亮数据(CheckMate 040中,在未经sorafenib治疗的患者,nivo组OS达到20个月以上),直接上III期试验硬刚索拉非尼,而且是优效性设计,虽然整体OS获益是向好的,但最终没达到预设结果。如果当初步子走的稳一些,按照先设计为非劣效试验,取得阳性结果后再循序渐进,看能否转换为有效检验?会否也早已批准了适应症?毕竟在CM459研究中,ORR和毒副反应等数据还是很棒的。可惜,历史不容假设。 - 卡博替尼与免疫检查点抑制剂联合治疗实体瘤,已经显示出临床活性
- COSMIC-312试验评估了卡博替尼联合阿替利珠单抗与索拉非尼作为晚期肝癌一线系统治疗的效果。
- COSMIC-312试验(NCT03755791)是一项开放标签、随机、III期临床试验,纳入的患者来自32个国家,178个中心,年龄≥18岁晚期肝癌患者,之前未接受系统抗肿瘤治疗和跟机制治疗或局部治疗,共计有837例。
- 纤维板层癌、肉瘤样肝细胞癌或肝细胞胆管混合癌患者排除。
- 患者具有可测量的肿瘤病灶(RECIST 1.1),BCLC B或C期, ECOG PS 0或1,Child-Pugh A级。
- 患者随机分配(2:1:1)为三组,分别为:卡博替尼(40mg QD PO)+阿替利珠单抗(1200mg Q3W IV );索拉非尼(400mg BID PO );卡博替尼(60mg QD PO)。
- 根据疾病病因、地理区域和是否存在肝外疾病或大血管侵犯进行分层。
- 该研究采用双终点,即由盲态独立评审委员会(BIRC)先对前372名随机分配到卡博替尼联合阿替利珠单抗组或索拉非尼组ITT人群的PFS(RECIST 1.1)以及所有患者的OS。
- 数据截止日期(2021年3月8日),2018年12月7日至2020年8月27日期间,共计纳入837名患者,分别接受卡博替尼联合阿替利珠单抗组(n=432)、索拉非尼组(n=217)、卡博替替尼组(n=188)。无进展生存ITT患者的中位随访时间为15.8个月(IQR 14.5–17.2),ITT患者的中位随访时间为13.3个月(10.5–16.0)。
- 联合治疗组的mPFS为6.8个月(99%CI 5.6–8.3),而索拉非尼组为4.2个月(2.8–7.0)(HR0.63,99%CI 0.44–0.91,p=0.0012)。
- 联合治疗组的mOS(中期分析)为15.4个月(96%CI 13.7–17.7),而索拉非尼组为15.5个月(12.1–不可估计)(HR 0.90,96%CI 0.69–1.18;p=0.44)。
- 最常见的3级或4级不良事件是丙氨酸转氨酶升高(联合治疗组429例患者中38例[9%]、索拉非尼组207例患者中6例[3%]、单药卡博替尼组188例患者中12例[6%]、高血压(37例[9%]vs 17例[8%]vs23[12%]、天冬氨酸转氨酶升高(37[9%]对8[4%]对18[10%])和掌底红细胞感觉障碍(35[8%]对17[8%]对16[9%]);78人(18%)发生了严重的治疗相关不良事件联合治疗组患者中,索拉非尼组16例(8%),单药卡博坦尼组24例(13%)。联合治疗组有6(1%)名患者(脑病、肝功能衰竭、药物性肝损伤、食管静脉曲张出血、多器官功能障碍综合征和肿瘤溶解综合征)发生与治疗相关的5级事件,索拉非尼组有1(1%)名患者(一般身体健康恶化),单药卡博替尼组(胃肠道出血)1例(<1%)。
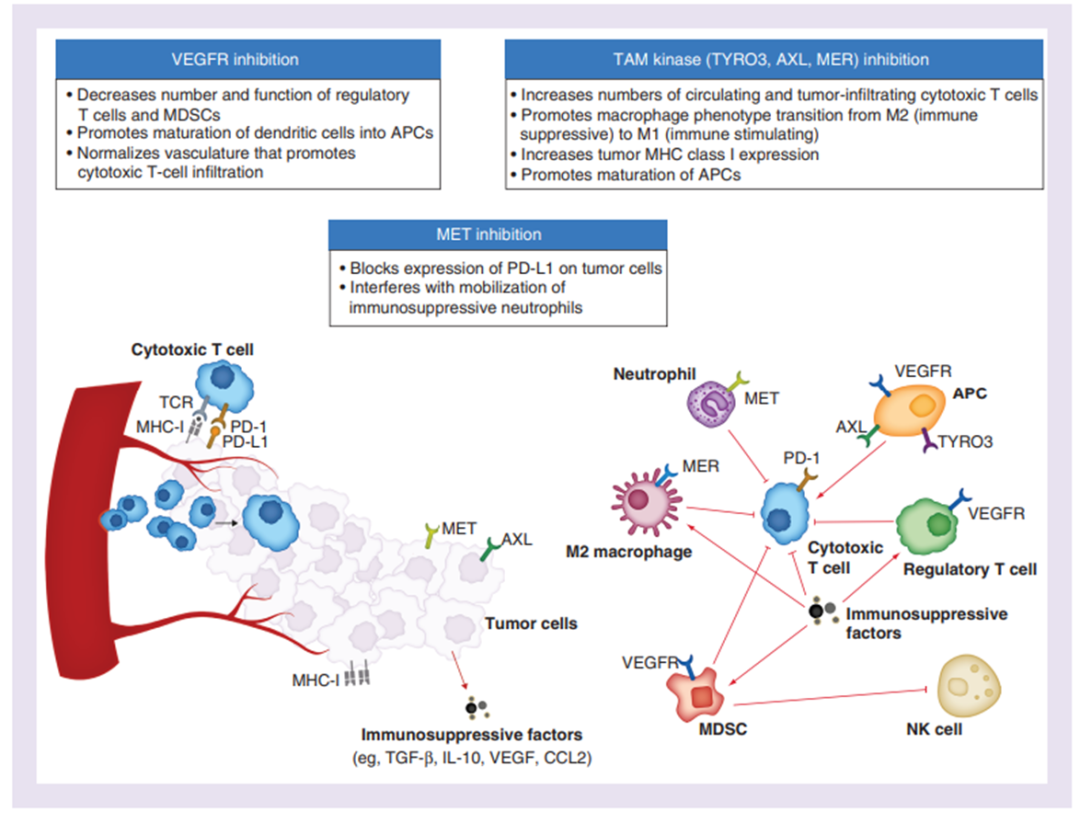
上面的内容,我们回顾了O药单药的失利、帕博利珠单抗联合仑伐替尼的失利,那唯一阳性结果的免疫联合试验,目前看有两个:T+A、D+T,那自然有个假设,PD-L1抗体联合抗血管靶向药,行不行呢?这就引出了COSMIC-312研究。卡博替尼靶向参与肿瘤发病机制的多受体酪氨酸激酶,包括促血管生成生长因子VEGFR和MET以及TAM激酶家族(酪氨酸3,AXL,MER),有助于解除肿瘤微环境中的免疫抑制环境。- 在III期临床试验(CELESTLAL),与安慰剂相比,卡博替尼在先前索拉非尼治疗后的OS和PFS所提高,因此卡博替尼被批准用于肝细胞癌患者的系统治疗。
- 卡博替尼联合免疫检查点抑制剂在几种实体瘤中显示出良好的临床活性,包括III期临床研究CheckMate 9ER,与舒尼替尼相比,PFS和OS有所提高,作为肾癌的一线治疗。
- 卡博替尼联合阿替利珠单抗的1b期试验显示了对几种不同实体瘤的临床活性,并确定了进一步开发的推荐联合剂量。
基于以上的证据链,卡博替尼开启了头对头对比索拉菲尼的三臂试验-COSMIC-312。足见信心很大,卡博替尼联合阿替利珠单抗,对比索拉菲尼,2打1还干不过吗?但盲目的自信,导致了最终OS的未获益。主要的原因,总结如下几点:- 对于停止研究治疗的患者,联合治疗组432名患者中有87名(20%)使用了随后的全身抗肿瘤治疗,索拉非尼组217名患者中有80名(37%)使用了后续的全身抗肿瘤治疗,单药卡博坦尼组188名患者中有54名(29%)使用了后续的全身抗肿瘤治疗。
- 联合治疗组有17(4%)名患者接受了免疫检查点抑制剂,而索拉非尼组有36(17%)名患者接受了免疫检查点抑制剂,单药卡博坦尼组有24(13%)名患者接受了免疫检查点抑制剂
- 与试验队列设计相比,我更关注的是其分层因素里有涉及病因,而我对于不同病因导致的HCC患者的免疫获益情况的不同,之前有过多篇文章的阐述。
- 我粗浅的认知中是为何全球的研究很多失败的,但在亚洲人群,尤其是中国亚组的数据,要明显高于其他亚组的数据呢?中国的HCC患者主要是乙肝病毒感染导致,在我国乙型病毒性肝炎相关肝癌占总病例数的75%~90%,在乙型病毒性肝炎相关肝癌的疾病进程中存在免疫失调机制,其中PD-1和CTLA-4等免疫抑制因子过表达引起T细胞失活,参与了病毒感染慢性化,肝炎自限性发展及肝癌发生、发展等诸多过程。可能更会从免疫治疗中获益。
- 那这种情况,在COSMIC-312试验中也是如此。虽然整体OS数据是失败的,但在ITT人群的HBV亚组(n=191),卡博替尼+阿替利珠单抗组和索拉非尼单药组的mOS分别为18.2个月和14.9个月(HR 0.53;95%CI:0.33~0.87);在HCV亚组(n=203),两组的中位OS分别为13.6个月和14.0个月(HR 1.10;95%CI:0.72~1.68);在非病毒组(n=255),两组的中位OS分别为15.2个月和未达到(HR 1.18:95%CI:0.78~1.79)。也验证了HBV感染导致的HCC更能从免疫联合治疗中获益。
绕了半天,似乎还是归因到HBV-HCC患者比例上。从机制上来看,可能部分原因在于HBV长期感染刺激下,PD-1和CTLA-4等免疫检查点受体表达量很高,单一免疫靶点单抗药物治疗效果有限。这也是为何O+Y和D+T能在晚期HCC 二线和一线研究都有效果的原因吧。那国内的康方生物的AK104(PD-1/CTLA-4双抗)联合仑伐替尼,康宁杰瑞KN046(PD-L1/CTLA-4双抗)联合仑伐替尼,在晚期HCC一线的探索结果也都不错,似乎圆满解释了这一点。整体而言,HCC未来的治疗方案,多靶点组合方案是其中具有前景的一种方式。HCC的试验设计,越来越难了。 版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。


















发表评论
注册或登后即可发表评论
登录注册
全部评论(0)