生命体是一个非常复杂的动态系统,此刻这一秒已不是前一秒的样子。因此,即使是那些最重要且经过充分研究的部分,也可能会错过一些不可思议的细节。 例如,在形成哺乳动物身体的过程中,滋养全身的 血液 来源于哪里?一直以来,生物学教科书告诉我们,血液起源于少数最终成为造血干细胞的细胞。 然而最近,一项突破性的发现颠覆了这一经典理论。 2022年6月15日,发表在 《Nature》 上的一项新研究中,来自哈佛大学和波士顿儿童医院的研究团队意外地发现血细胞并非来自一种母细胞,而是两种:这群不是来自干细胞的祖细胞,会在胎儿时期到成年的过程中产生大部分血液,然后随着年龄增长逐渐减少。它们是被称为 胚胎多能祖细胞 (eMPP)的细胞。看来,血细胞家族树需要一个新的祖先分支了。

这一发现将为白血病和骨髓移植领域带来重要的见解,还可以为改善人类免疫系统开辟新的途径。 追踪细胞的谱系历史是回答生物学中各种基本问题的关键。 多年来,哈佛大学干细胞与再生生物学系首席研究员Fernando Camargo领导的研究团队一直在开发一种类似细胞条形码的策略。
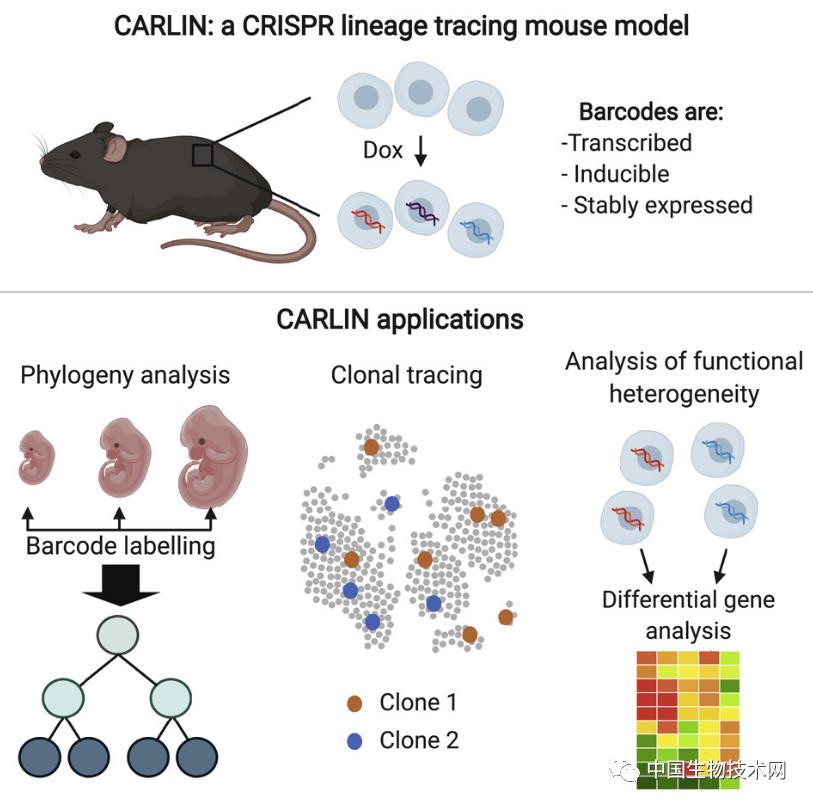
使用CRISPR基因编辑技术,研究人员将一种独特的遗传密码植入小鼠胚胎细胞,从而使所有来自条形码细胞的细胞都携带相同的基因序列,这使科学家更容易 观察到小鼠从出生后到成年期体内出现的所有不同类型的血细胞。

最早的造血细胞群在小鼠胚胎脐动脉壁中产生。红色细胞代表胚胎多能祖细胞 Camargo解释说:“以前,研究人员没有这些工具,所以观察不到这群细胞。此外,干细胞产生所有血细胞的观点在这一领域已根深蒂固,因此,没有人会质疑它。通过追踪小鼠细胞随时间推移发生的改变,我们观察到新的生物学现象。” 凭借细胞条形码策略,研究人员发现胚胎多能祖细胞实际上是比正常血液干细胞更丰富的淋巴细胞来源。淋巴细胞在免疫反应中发挥着关键作用,包括B细胞和T细胞。 虽然造血干细胞也可以产生这些免疫细胞,但数量却非常有限。它们往往会产生更多形成血液巨核细胞的祖细胞,这些是凝血所需的成分。

Camargo认为,胚胎多能祖细胞的减少解释了为什么随着年龄的增长,免疫系统也会随之减弱。 他说:“我们现在正在试图理解为什么这些细胞在中年时会逐渐消失。如果可以操纵它们,也许可以恢复免疫系统的活力。” 目前有两种方式可以实现这一目标:一种可以通过使用生长因子或免疫信号分子来延长胚胎多能祖细胞的寿命;另一种是使用基因疗法来治疗血液干细胞,以使它们更像胚胎多能祖细胞。 该团队认为,他们这项突破性研究为血癌如何攻击人体免疫系统带来新的认识。Camargo怀疑通常攻击老年患者的髓性白血病可能起源于造血干细胞。同时,主要发生在儿童中的淋巴白血病可能起源于胚胎多能祖细胞。 该团队正在通过观察突变对小鼠血液干细胞和胚胎多能祖细胞的影响,来了解导致白血病的突变后果。他们想确定这些不同来源的细胞所产生的白血病(骨髓性白血病还是淋巴白血病)是否相同。 Camargo说:“当我们试图对小鼠进行骨髓移植时,我们发现胚胎多能祖细胞移植的失败率很高,通常只能持续几周。如果我们可以添加一些基因来让胚胎多能祖细胞保持长期移植效果,它们可能成为更好的骨髓移植来源。在年轻的骨髓供体中,胚胎多能祖细胞比造血干细胞更常见,并且能够产生淋巴细胞,这可以更好地重建免疫系统,并减少移植后的感染并发症。”
来源:中国生物技术网 2022-06-20





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)