2022-09-05 来源 : BiG生物创新社 ,作者BiG专栏
摘要
SARS-CoV-2在人类中的传播通过直接接触、呼吸道飞沫、受污染的物体和气溶胶发生,全基因组长度约为29.8kb,有几个开放阅读框架(ORF)。第一个ORF(ORF1a/b)编码病毒复制和转录所需的多蛋白(nsp1-nsp16),其余13个ORF编码辅助蛋白和结构蛋白,包括刺突(S)、膜(M)、包膜(E)和核衣壳(N)。动物模型在SARS-CoV-2机制和治疗研究中起着至关重要的作用。

COVID-19的临床特征
1.1一般临床症状
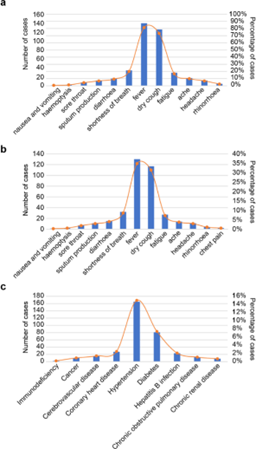
SARS-CoV-2感染患者的特征性表现为肺炎并伴有其他相关症状。最常见的症状是发烧(超过90%)和咳嗽(超过80%)。患者的临床症状及发生率总结见图1a。病毒变异会引起不同的临床症状和不同的发病率,且特定亚人群的发病率和死亡率存在差异。
1.2在不同人群中出现的感染情况
患有基础慢性疾病的老年人更容易发展为严重或危重疾病,导致住院、急性呼吸窘迫综合征和死亡。患有SARS-CoV-2感染的孕妇出现发烧(7/9)、咳嗽(4/9)、肌痛(3/9)、喉咙痛(2/9)、腹泻(1/9)和呼吸困难(1/9)。儿童感染约占COVID-19病例总数的15%,临床表现包括皮肤病变以及呼吸道、胃肠道和神经症状。COVID-19严重程度还存在性别差异。男性似乎比女性更容易感染COVID-19。
1.3已有疾病患者的感染
在一项对41名患者的研究中,32%为慢性疾病患者,如心血管疾病、糖尿病或高血压。慢性患者症状与无既往有疾病的一般人群相似(图1b),但他们的发热和疲劳率较高,这可能是免疫反应受损的结果。共病患者约占所有COVID-19患者的30%,共病的发生率见图1c。
1.4中枢神经系统的感染
冠状病毒还可以通过突触连接侵入中枢神经系统。最常见的精神病症状是妄想、幻觉,思维、行为和言语混乱,甚至是紧张性精神分裂症。嗅觉丧失是COVID-19患者的一种常见且往往是唯一的症状。
1.5胃肠道感染及损伤
超过80%的COVID-19患者有一个或多个消化症状的疾病。有胃肠道症状的COVID-19患者多发展为严重疾病,导致死亡风险较高。
1.6血液学和生化参数
COVID-19患者的血液样本报告出现血小板减少,淋巴细胞减少,白细胞比例低。且大部分患者的ALT、AST、CPR、D-二聚体和肌酸激酶水平升高。
1.7对生殖系统的影响
早期流行病学调查中约40%的患者性欲较低,且COVID-19引起的心血管功能障碍会导致勃起功能衰竭。此外,在COVID-19患者的睾丸中精母细胞脱落和精子细胞伸长,表明急性睾丸损伤。

介导SARS-COV-2
感染的受体和细胞蛋白酶
2.1 经典的受体和新的候选受体
ACE2是最被广泛认可的SARS-CoV-2受体。CD147-刺突蛋白相互作用是SARS-CoV-2感染宿主细胞的一种途径。ASGR1介导半乳糖终止糖蛋白内化到肝细胞中,并在溶酶体中降解。基因组受体谱发现ASGR1和KREMEN1可能是SARS-CoV-2进入细胞的替代功能受体。SARS-CoV-2感染通过可能受既往病理状态和NRP1肝脏表达影响的途径促进肝损伤。DPP4,AGTR2,ANPEP,ENPEP是SARS-CoV-2感染的候选受体。
表1 SARS-CoV-2和其他冠状病毒进入的可能受体和蛋白酶
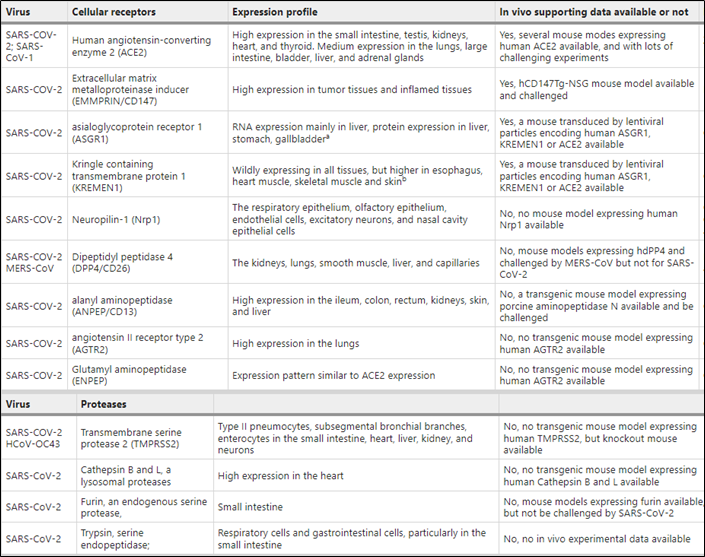
2.2介导SARS-CoV-2病毒进入的蛋白酶
TMPRSS2在SARS-CoV-2感染和细胞进入中发挥着关键作用。组织蛋白酶B和L是SARS-CoV-2进入HEK 293/hACE2细胞的关键蛋白酶。内源性丝氨酸蛋白酶furin切割S蛋白的能力增加SARS-CoV-2对ACE2受体结合亲和力。丝氨酸内肽酶胰蛋白酶可能是有助于SARS-CoV-2进入的蛋白酶之一。其他常见的宿主因子,如CSNK2B、GDI2、SLC35B2、DDX51、VPS26A、ARPP-19、C1QTNF7、ALG6、LIMA1、COG3、COG8、BCOR、LRRN2和TLR9也可能调控SARS-CoV-2感染。

COVID-19动物模型
3.1非人灵长类动物
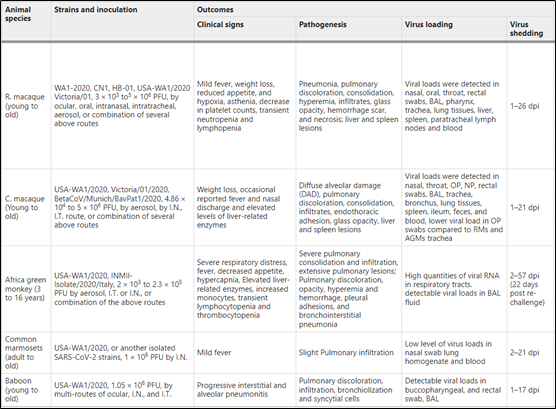
非人灵长类动物(NHPs)在生理特征和免疫调节方面与人类有很大的相似性,已加紧利用其来开发COVID-19疾病模型(表2)。恒河猴是最常用的COVID-19疾病模型,但NHPs正面临着巨大的需求和不断飙升的成本,因此可能有必要寻找替代模式。
表2 SARS-CoV-2 非人灵长类动物模型
3.2小鼠模型
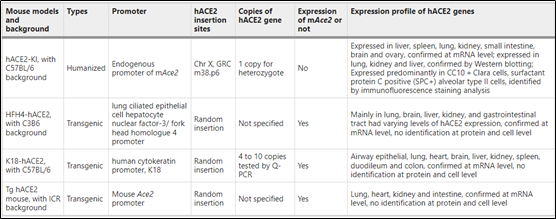
▪稳定遗传的转基因小鼠模型。稳定遗传转基因小鼠模型表达hACE2后,导致SARSCoV-2易感性,可用于疫苗和药物的临床前评估。在某些HFH4-hACE2和K18-hACE2小鼠感染模型(表3)中观察到肺功能受损,在老年小鼠中存在更有效的病毒复制和严重的疾病表现。
表3 hACE2可遗传转基因小鼠基本信息
hACE2在不同SARS-CoV-2毒株SARS-CoV-2小鼠模型中表达模式的差异,以及不同的感染途径和病毒剂量,导致了不同的临床表现和病理改变(表4)。
表4 用稳定遗传的转基因小鼠建立的 SARS-CoV-2 模型
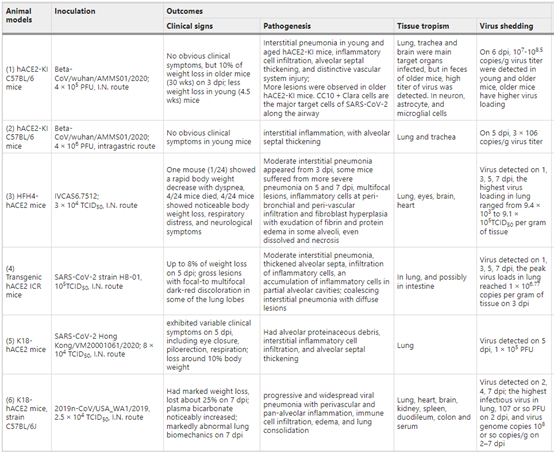
▪通过Ad5-hACE2或AAV-hACE2转导致敏的小鼠模型。使用表达hACE2的腺相关载体或腺病毒5(AAV-hACE2,Ad5-hACE2)在腺气管内转导小鼠,导致肺组织中hACE2表达,使病毒进入和感染(表5)。
表5 Ad5-hACE2 或 AAV-hACE2 转导致敏的小鼠模型
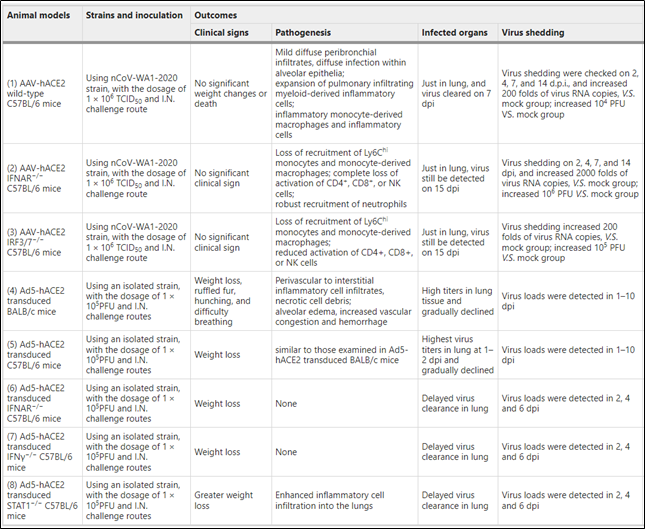
▪基于小鼠适应的SARS-CoV-2菌株的模型。SARS-CoV-2感染BALB/c小鼠后的肺匀浆鼻内接种年轻小鼠,会产生小鼠适应的病毒株WBP-1。WBP-1在BALB/c中表现出更高的传染性。通过连续传代积累突变和精确的反向遗传技术可以建立适应小鼠的菌株(表6)。
表6 基于小鼠适应株SARS-CoV-2 的模型
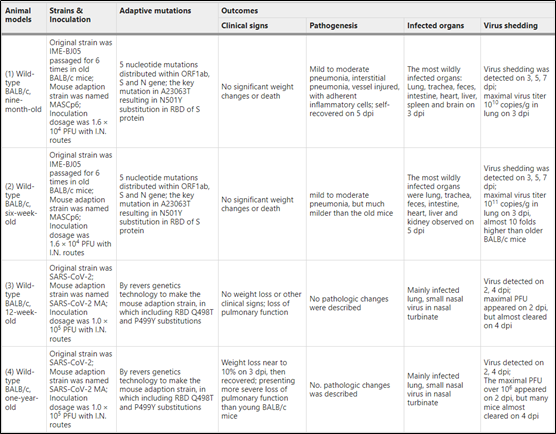
▪用移植的人体组织或细胞建立的人源化小鼠模型:SCID-hu肺小鼠模型以及最近建立的与人类胎儿肺组织和髓系增强的人类免疫系统共移植的小鼠模型
3.3叙利亚仓鼠模型
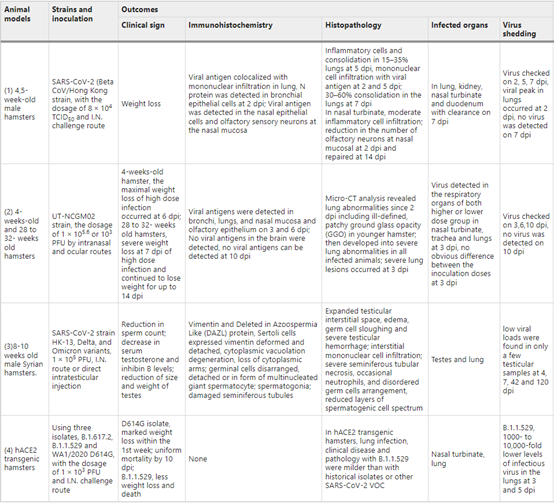
仓鼠感染SARS-CoV-2后会出现呼吸道和肺部疾病,且其他生理系统也会受到长期损害,病毒载量可以在呼吸道检测到。在仓鼠中也测试了密切接触传播模型,表明与携带SARS-CoV-2的仓鼠共住接触是传播疾病的有效方式。
表7 SARS-CoV-2 叙利亚仓鼠模型
3.4雪貂和水貂模型
雪貂和水貂都是雪貂科的成员,对几种人类呼吸道病毒高度敏感。感染SARS-CoV-2后,雪貂表现出常见的临床症状,病理检查显示不同程度肺损伤。雪貂和水貂的突出用途是用于传播研究。
3.5家禽和家畜
猫,狗,鸡、猪和鸭都可进行SARS-CoV-2感染,但没有表现出临床体征,提示可能不适合建立体内模型。绵羊被感染后只支持有限的病毒复制,可通过呼吸道飞沫或气溶胶发生。

现有模型和未来展望的差距
4.1现有动物模型的缺陷
(1)可能需要开发能够发展为更严重疾病的模型。
(2)支持长时间病毒复制的易感动物模型仍未被广泛使用。
(3)有必要建立研究共病对SARS-CoV-2感染影响的模型。
(4)有必要建立模拟衰老对SARS-CoV-2感染和免疫的影响的动物模型。
(5)迫切需要能够重现COVID-19疾病进展和从轻度疾病向重度疾病转变的动物模型。用于识别新的生物标志物,更好地预测人类疾病的病程。
(6)动物模型SARS-CoV-2 VOC至关重要,用于评估致病性和传播性,以及疫苗和治疗方案的效果。
(7)可能有必要建立具有Th1和Th2反应的动物模型。
(8)下一阶段的研究迫切需要具有双源和三重人源化基因组合的动物模型,而不是单一的转基因
4.2下一代COVID-19动物模型的发展策略
▪具有单基因或多基因组合的转基因小鼠。新的潜在受体,包括CD147、ASGR1、KREMEN1和Nrp1,可能在构建小鼠模型中值得尝试。自然免疫缺陷或实验诱导免疫缺陷的动物模型可能延长SARS-CoV-2的体内复制,用于研究COVID-19的后遗症。可用人源化或转基因hACE2小鼠可以用来构建老年或共病小鼠模型研究老年COVID-19以及既往存在共病的(如心脏病、糖尿病和癌症)病症。
▪转基因或基因敲入策略的选择。通过将hACE2受体或其他由小鼠固有启动子驱动的外源基因插入mACE2或类似基因的位点,生成为ACE2受体或其他基因人源化的动物模型。Safe harbor 位点,如Rosa26、和Hipp11越来越成为异源基因插入的首选。可以使用强大的启动子,如CAG启动子,而不是小鼠固有的启动子,以消除干扰,同时仍然保证强表达。
▪动物模型的遗传背景。表达hACE2的BALB/c小鼠可以模拟COVID-19的肺部病理和晚期后遗症。野生型仓鼠允许SARS-CoV-2感染,但如果引入hACE2基因,可能受益于增强易感性。野生型雪貂也可能感染SARS-CoV-2,如果有天然的ACE2基因被人源化,可能会产生更严重的症状。

提前保留动物模型
这是新冠肺炎大流行的一个教训
为应对紧急和不可预测的新传染病爆发,非常有必要提前维持一群自然易感动物模型,并为那些缺乏易感动物模型的病原体建立转基因小鼠模型。
鉴于呼吸道病原体的快速传播和巨大危害,应更加重视建立和保存呼吸道病原体的动物模型,如冠状病毒、呼吸道合胞病毒或可通过呼吸道途径传播的肠道病毒,如EV-D68。
胚胎和精子的冷冻保存成本要低得多,体外受精(IVF)技术可以实现在一两个月内生产出数(表8)。
表8 体外受精(IVF)技术快速培育hACE2-KI人源化小鼠
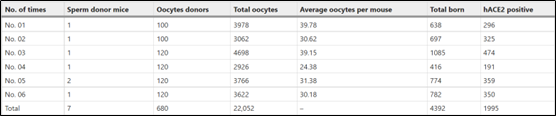
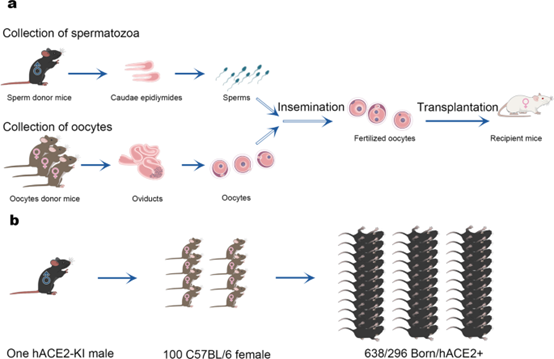
图2 利用体外受精 (IVF) 技术快速培育 hACE2-KI 模型小鼠
结论
现有的COVID-19动物模型在疫苗和治疗方法的开发中发挥着关键作用。但面对COVID-19大流行的新阶段,科学界应重点建立多基因转基因动物模型和VOC感染模型。与其他物种相比,小鼠更容易进行转基因,并且有丰富的免疫资源,因此小鼠模型将成为研究COVID-19复杂临床特征和疾病进展的最先进工具。与此同时,迫切需要储备动物资源以应对未来的新兴传染病。
参考文献:
Fan, C., Wu, Y., Rui, X. et al. Animal models for COVID-19: advances, gaps and perspectives. Sig Transduct Target Ther 7, 220 (2022). https://doi.org/10.1038/s41392-022-01087-8
封面来源:https://zhuanlan.zhihu.com/p/133905619
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)