巨胞饮(Macropinocytosis)作为高度保守的内吞途径,生理情况下在胞外物质(如生长因子)刺激下细胞膜形成褶皱,进而形成巨胞饮囊泡介导内吞。在细胞中,巨胞饮活动严格受到多种参与肌动蛋白、微丝重构、皱褶形成、囊泡形成等关键蛋白的调控。囊膜病毒如埃博拉病毒、流感病毒、HIV 病毒、痘病毒等均可利用巨胞饮途径进入细胞,并且在病毒感染后期细胞间传播中起到重要作用。SARS-CoV-2的病毒进入(Entry)主要由囊膜纤突蛋白(Spike)与细胞ACE2受体结合启动,通常包含两种途径:细胞表面病毒囊膜与细胞膜直接融合以及利用细胞内吞途作用介导的内体融合。目前研究表明冠状病毒的内体融合途径主要依赖小窝蛋白介导的内吞(CVME)、网格蛋白介导的内吞(CME)以及脂筏(Lipid raft)介导的内吞。但是否能利用巨胞饮介导内吞的机制尚不清楚。2022年9月21日,中国农业科学院哈尔滨兽医研究所联合香港大学在国际学术期刊《JOURNAL OF BIOLOGICAL CHEMISTRY》以Article的形式在线发表了题为“SARS-CoV-2 hijacks macropinocytosis to facilitate its entry and promotes viral spike mediated cell-to-cell fusion”的最新研究成果。首先研究人员在Vero E6易感细胞以及TMPRSS2高表达细胞Caco 2 分别验证了三组内吞途径抑制剂对病毒复制的作用,结果表明,包括巨胞饮抑制剂EIPA在内的三组抑制剂处理显著影响了SARS-CoV-2的病毒复制,揭示了在两种进入途径偏好不同的细胞系中(A)Vero E6,(B)Caco2,巨胞饮途径均参与病毒复制(图1)。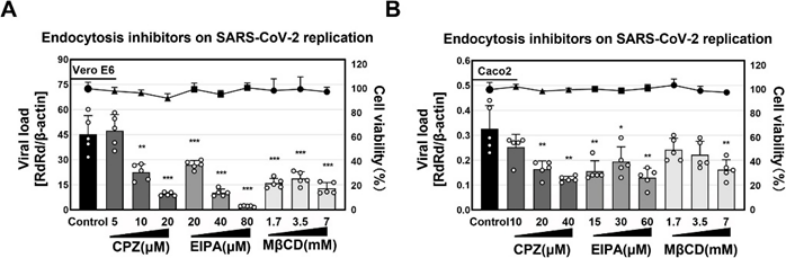
图 1:巨胞饮作用参与 SARS-CoV-2 的生命周期。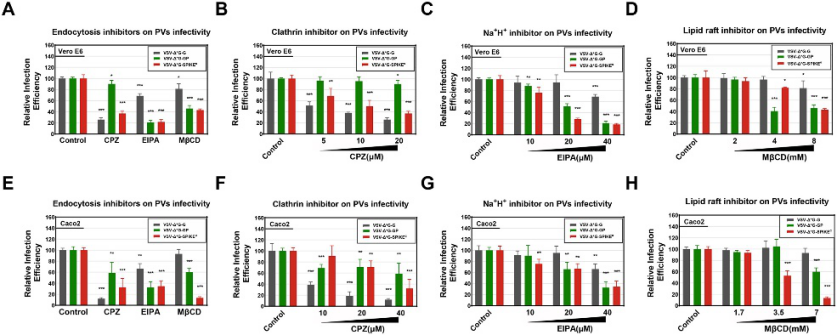
图 2:巨胞饮抑制剂EIPA显著影响SARS-CoV-2的进入。为了揭示巨胞饮参与病毒复制的调控机制,作者使用伪病毒(PesudotypedVirus)系统在两种细胞系分别验证了病毒进入(Entry)阶段对三种内吞途径的依赖性。结果显示SARS-CoV-2的病毒进入(Entry)在不同的细胞系均表现出对巨胞饮途径在内的多途径依赖性,表面巨胞饮作用在病毒感染最初阶段的重要作用(图2)。并且TMPRSS2的表达可以部分恢复巨胞饮抑制剂造成的进入抑制,表明当存在TMPRSS2的情况下,细胞的入胞途径倾向于直接的膜融合(图3)。
图 3 TMPRSS2改变了EIPA对伪病毒的进入抑制。为了进一步揭示SARS-CoV-2进入阶段利用巨胞饮的调控分子机制,作者利用RNAi技术以及显性负性突变体(dominant negative mutant)技术验证了Rho家族small GTPase Cdc42、Rac1、Pak1以及RhoA(对照)等不同巨胞饮通路调控蛋白对SARS-CoV-2进入的调控作用。研究发现明Rho家族small GTPase Rac1、Pak1蛋白对巨胞饮依赖的病毒进入至关重要(图4)。 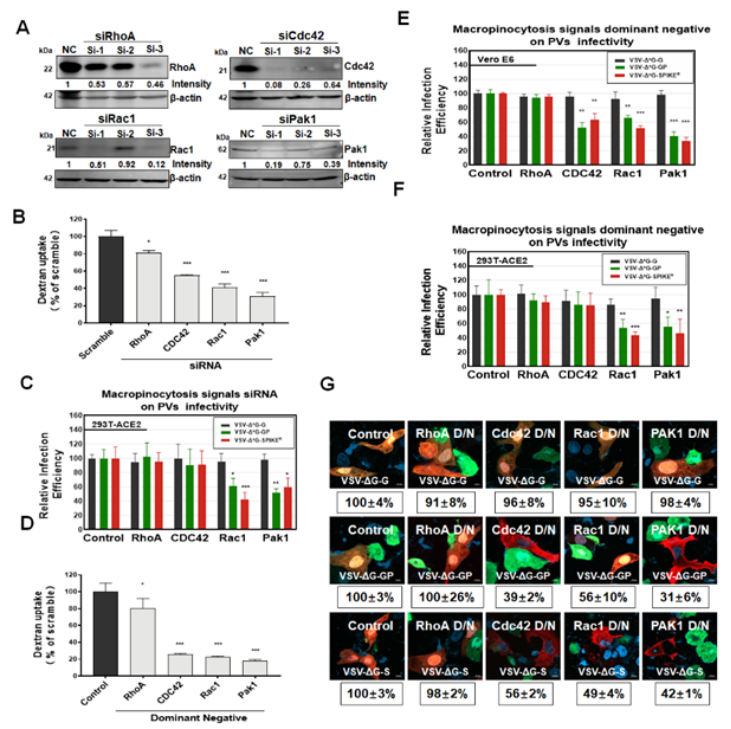
图 4: 抑制巨胞饮信号通路传导影响SARS-CoV-2进入。最后,研究人员利用膜融合评价系统验证了巨胞饮抑制剂以及下游信号通路对病毒感染后期细胞间膜融合的影响。研究结果表明抑制巨胞饮途径可以显著影响SARS-CoV-2 S蛋白诱导的细胞间膜融合(图5)。
图 5: 内吞抑制剂显着抑制 SARS-CoV-2 刺突蛋白诱导的合胞体。这些结果详细阐述了巨胞饮参与SARS-CoV-2病毒复制生命周期的早期进入以及后期细胞间传播的分子机制,也为新冠病毒的抗病毒药物研发提供参考。张育源硕士、梁荣辉博士、王淑杰副研究员为本文的共同第一作者,哈尔滨兽医研究所蔡雪辉研究员,尹鑫研究员,汤艳东副研究员,香港大学袁硕峰博士为本文的共同通讯作者。 版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。











发表评论
注册或登后即可发表评论
登录注册
全部评论(0)