2022-10-27 来源 : 学术查
编者按: 回顾20年来的研究数据,我们发现氧化应激相关的研究呈线性增长,可见该领域的火热程度。氧化应激相关的研究角度主要有三方面,一是促进氧化应激的角度,二是从抗氧化应激的角度,三是从氧化系统和抗氧化系统平衡的角度,第一个方面研究的较多,第二、第三则相应较少。下面这篇文章就是从抑制氧化应激的角度展开研究,探究了抑制氧化应激在疾病中的分子作用机制,值得借鉴;广泛阅读,精细研读,深入学习,开拓研究思路的必经之路。
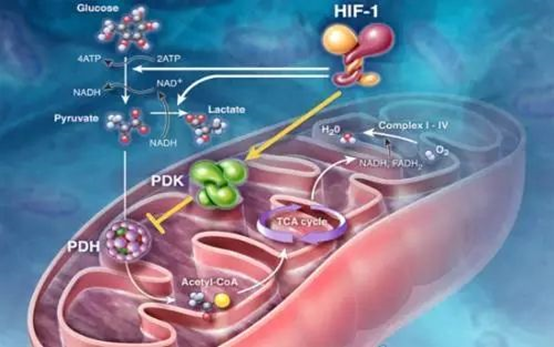
氧化应激反应
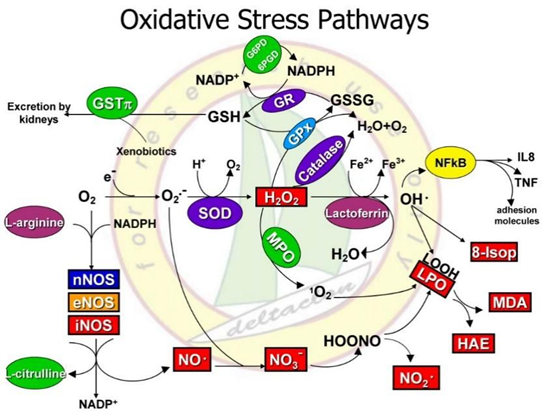
氧化应激调控通路

文献推荐
今天带给大家的思路是来自苏州大学的发表在Journal of Cellular Physiology 上题为“SIRT3 mitigates intervertebraldisc degeneration by delaying oxidative stress-induced senescence of nucleuspulposus cells”的文献,主要讲的是SIRT3基因通过延缓氧化应激诱导的髓核细胞衰老进而减轻椎间盘退变的分子机理。


文献概述
髓核 (NP) 细胞 (NPC) 的衰老是椎间盘退变 (IVDD) 的主要原因,因此延迟NPC衰老可能有利于减轻IVDD。作者研究证明由AMPK/PGC-1α通路介导的SIRT3通过延迟氧化应激诱导的NPC衰老来减轻IVDD。

分子机制图

研究思路
1、SIRT3在退化的NP组织中低水平表达
临床上正常和退化的NP组织的T2加权MRI扫描显示,变性组的信号强度明显低于正常组(图1a)。针刺诱导的大鼠IVDD模型中T2加权MRI结果与临床标本的结果一致(图1b)。H&E和番红-O染色显示,退化的NP组织中NPC和ECM的数量显著减少(图1c-d),与氧化应激相关的iNOS和Ac-SOD2的表达显著高于正常组(图2a-d)。免疫组织化学染色结果表明,无论样本是人还是大鼠SIRT3表达明显下降,变性组NP组织中p16INK4α的表达增加(图2e-h)。这些结果表明SIRT3可能与NPC衰老有关。
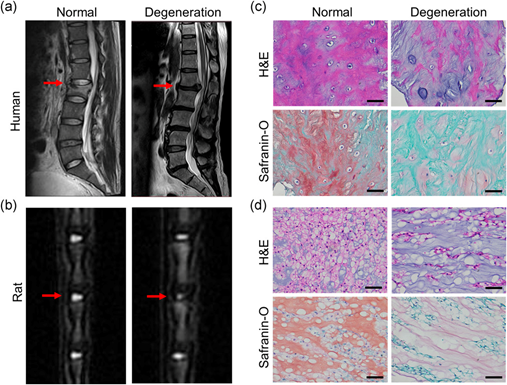
图1
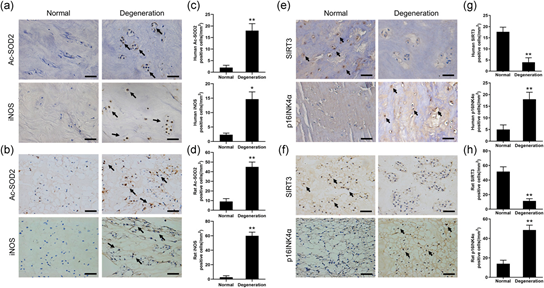
图2
2、SIRT3在H2O2诱导的NPC中高表达
在用75μM H2O2处理12h的NPC中,ROS和iNOS的表达水平明显增加(图3a-d)。蛋白质印迹结果表明H2O2组中Ac-SOD2/SOD2的比率明显高于对照组(图3e-f)。H2O2组中SA-β-Gal阳性NPC的百分比比对照组高3.2倍(图3g-h)。H2O2组中p16INK4α和SASP,如IL-1β、IL-6、MMP3和MMP9的表达水平显著增加(图3i-k)。这意味着氧化应激诱导了NPC的衰老。H2O2组中Col2和蛋白聚糖的表达降低,而MMP13的表达增加(图3l-p)。在衰老的NPC中可以看到ECM的退化。有趣的是,用H2O2处理的NPC中的SIRT3表达明显高于对照细胞(图3q-r)。此外,蛋白质印迹结果表明用H2O2处理的NPC中SIRT3表达的剂量和时间依赖性增加(图3s-t)。这些数据表明SIRT3可能对氧化应激诱导的衰老NPC发挥保护作用。
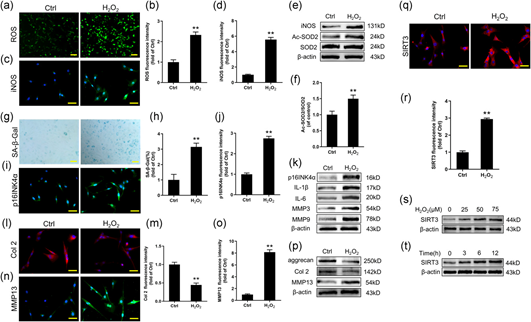
图3
3、靶向调控SIRT3可影响H2O2诱导的NPC衰老
当SIRT3表达沉默时,细胞内iNOS表达和ROS产生显著增加;相反,SIRT3表达的上调降低了这些氧化应激标志物的水平(图4a-d)。蛋白质印迹结果显示在SIRT3表达沉默后Ac-SOD2/SOD2比率显著增加,而SIRT3过表达有效降低了该比率(图4e-f)。LV-shSIRT3+H2O2组SA-β-Gal阳性细胞比例和p16INK4α表达显著高于LV-Ctrl组和LV-Ctrl+H2O2组,而过表达SIRT3显著降低SA-β-Gal的比例阳性细胞和p16INK4α表达(图4g-j)。无论是蛋白质还是mRNA水平,NPC各组间p16INK4α和SASP表现出非常相似的趋势(图4k)。基于上述结果,SIRT3可以保护NPC免受氧化应激诱导的衰老。免疫荧光染色显示NPC中的SIRT3过表达部分逆转了H2O2干预后Col2表达的减少和MMP13表达的增加(图4l-o)。此外,RT-PCR和蛋白质印迹结果表明,在氧化应激下,低SIRT3表达的NPC中聚集蛋白聚糖和Col2的表达水平显著低于LV-Ctrl+H2O2组的细胞;相比之下,LV-SIRT3+H2O2组的MMP13表达明显高于LV-Ctrl+H2O2组。同时,SIRT3过表达挽救了聚集蛋白聚糖和Col2表达的减少,并抑制了氧化应激诱导的MMP13表达的增加(图4p)。这表明SIRT3减弱了H2O2诱导的NPC变性。
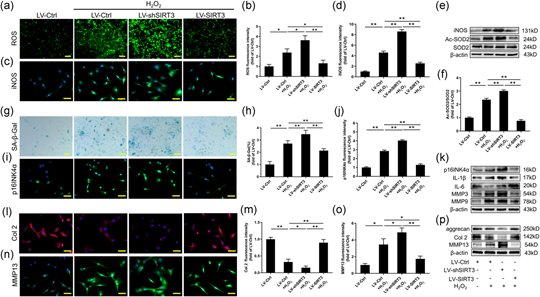
图4
4、AMPK/PGC-1α信号通路参与SIRT3对H2O2诱导的NPC衰老的调控
采用AMPK激动剂(AICAR)和AMPK抑制剂(化合物C)预处理转染了LV-shSIRT3的NPC或LV-SIRT3,然后将细胞暴露于H2O2。WB结果表明,LV-shSIRT3+AICAR+H2O2组的p-AMPK/AMPK比值明显高于LV-shSIRT3+H2O2组;相比之下,LV-SIRT3+化合物C+H2O2组的这一比例明显低于LV-SIRT3+H2O2组(图5a-b)。PGC-1α表达分别随着AMPK的激活或抑制而增加或减少。然而,SIRT3过表达组的PGC-1α表达明显高于低表达组(图5c)。此外,SIRT3表达分别随着AMPK的激活和抑制而显著增加和减少(图5d)。
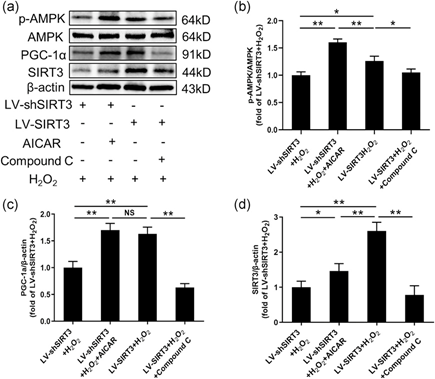
图5
WB分析显示,每组中iNOS的表达和Ac-SOD2/SOD2的比率与iNOS免疫荧光染色的结果相似(图6e-f)。NPC中AMPK活性的激活显著减少了LV-shSIRT3诱导的SA-β-Gal阳性细胞的数量;相反,NPC中AMPK活性的抑制明显增加了LV-SIRT3减少的SA-β-Gal阳性细胞的数量(图6g-h)。此外,免疫荧光染色结果也说明AMPK的激活降低了p16INK4α的表达,p16INK4α通过沉默SIRT3而在NPC中高表达;相反,在LV-SIRT3干预后,NPC AMPK活性的抑制明显增加了p16INK4α的表达(图6i-j)。此外,RT-PCR和蛋白质印迹结果表明,不同组间p16INK4α和SASP的表达变化在mRNA和蛋白质水平上表现出一致性(图6k)。AMPK/PGC-1α通路确实参与了H2O2诱导的NPC衰老中SIRT3的调节。AMPK的激活可以在一定程度上逆转LV-shSIRT3和H2O2对NPC中Col2表达的抑制;相反,AMPK的抑制明显减弱了LV-SIRT3在调节用H2O2处理的NPC中Col2表达的补救作用(图6l-m)。然而,参与ECM降解的MMP13的表达与Col2的表达相反(图6n-o)。蛋白聚糖、Col2和MMP13的蛋白质印迹和RT-PCR结果进一步证实了这些结论(图6p)。
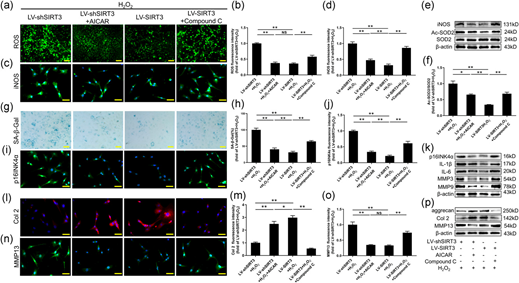
图6
5、SIRT3的靶向调控影响体内IVDD的过程
X射线结果发现,与对照组相比赋形剂组的DHI下降了34.5%;与赋形剂组相比LV-shSIRT3组的指数也下降了19.5%。相反,与载体和LV-shSIRT3组相比,LV-SIRT3组的DHI分别增加了23.9%和53.9%(图7a-b)。此外,MRI扫描结果显示,与对照组相比,Vehicle组的IVD光密度降低了37.4%。与载体组相比,LV-shSIRT3组的IVD光密度降低了17.7%。然而,LV-SIRT3组的IVD光密度分别是载体组的1.4倍和LV-shSIRT3组的1.7倍(图7c-d)。这些结果表明SIRT3的局部过表达减轻了IVDD期间椎间隙和水含量的减少。H&E和番红-O染色表明,对照组的NP呈大而饱满的椭圆形,而其他三组的NP呈不规则形状,三组的体积均小于对照组的NP(图7e)。载体组的组织学等级是对照组的2.1倍,LV-shSIRT3组的等级也比载体组的等级提高了23.2%。更重要的是,与载体和LV-shSIRT3组的值相比,LV-SIRT3组的值分别降低了28.1%和41.6%(图7f)。免疫组织化学染色表明SIRT3过表达提高了Col2的表达,同时也降低了IVDD中MMP13的表达。相反,SIRT3敲低进一步加剧了Col2的丢失,但促进了MMP13表达(图7g-h)。LV-shSIRT3进一步降低了退化NP组织中的SIRT3表达;相反,LV-SIRT3显著改善了退行性NP组织中的SIRT3表达(图8a)。这表明局部SIRT3过表达干预可以降低穿刺诱导的IVDD,而局部SIRT3敲低会加重IVDD。
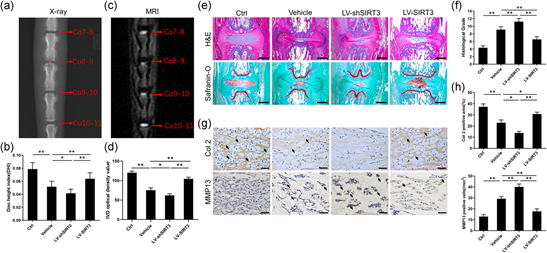
图7
载体组的NP组织中iNOS和Ac-SOD2阳性细胞的数量高于对照组。该结果表明,穿刺诱导的IVDD NPC中的氧化应激水平增加。LV-shSIRT3干预进一步增加了退化NP组织中iNOS和Ac-SOD2的表达,而LV-SIRT3处理明显降低了退化NP组织中iNOS和Ac-SOD2的表达(图8b-c)。在NPC中沉默SIRT3表达显著增加了IVDD NP中衰老细胞的数量;相比之下,SIRT3过表达明显减少了IVDD NP中衰老细胞的数量(图8d-e)。这些结果表明,NPC中SIRT3表达的上调减轻了针灸诱导的椎间盘退变,同时也降低了NP中的氧化应激水平和衰老细胞的数量。
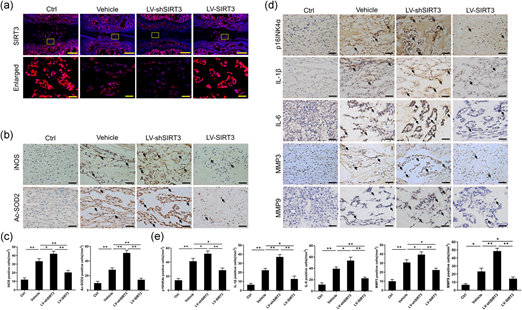
图8
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)