2022-11-18 来源 : 基因药物汇 ,作者医学部Erica
提到晚期、转移性非小细胞肺癌的治疗,大家首先想到的一定是靶向治疗、免疫治疗以及化疗。其中免疫治疗与靶向治疗共同构建了晚期非小细胞肺癌的精准治疗体系,让长期生存成为了可能。
关于免疫治疗、或者说以PD-1/PD-L1抑制剂为代表的一系列免疫检查点抑制剂的应用,我们都听过许多的“建议”:PD-L1表达水平更高、肿瘤突变负荷(TMB)更高以及微卫星不稳定性更高(MSI-H)的患者的疗效更好,某几种突变的患者疗效更好、某几种突变的患者疗效却很差,某几种突变的患者在靶向治疗耐药之后也可以转用免疫治疗,以及一项得到了越来越多认可的建议,更早使用免疫药物的患者预后更好。
部分靶向治疗耐药的患者可以用免疫治疗,但是免疫药物早期使用的疗效更好——于是一个疑问就自然而然地诞生了:将免疫检查点抑制剂的用药顺序提到靶向药物前面,疗效会不会更好呢?
还别说,真的有许多专家考虑了这个问题,并且付诸临床试验了。
1
先用免疫治疗、再用靶向治疗,效果如何?
派姆单抗早期的一项Ⅱ期临床试验(NCT02879994)当中也得到了相似的结果。该试验纳入了EGFR突变阳性、但未接受过靶向治疗的,PD-L1表达水平不少于1%的晚期非小细胞肺癌患者,计划接受派姆单抗单药治疗,并在治疗之后继续接受EGFR抑制剂靶向治疗。
但试验仅仅纳入11例患者就被叫停——这11例患者的治疗经历已经证实,这种治疗策略存在致命的风险,疗效又不好。
11例患者中仅有1例对派姆单抗的治疗有响应,缓解率仅9%;再次复查基因检测,研究者们惊讶地发现,这名对派姆单抗有响应的患者入组前的检测结果竟然错了——他其实根本没有EGFR突变!
事实上,EGFR突变的患者接受派姆单抗治疗的响应率是0!
患者的治疗相关不良事件(也就是我们俗称的副作用)发生率为46%。在研究进行的6个月内,已经有2例患者因严重的免疫相关不良事件死亡。其中1例患者死于非常严重的免疫相关性肺炎(5级),这例患者为EGFR 19号外显子缺失,且在治疗的过程中发生了腹泻(2级),治疗时间仅1.4个月。还有患者出现了3~5级的转氨酶升高,或3~5级的胃肠道反应(腹泻)。
很多其它临床试验都得到了相似的结论。奥希替尼联合德瓦鲁单抗(一款PD-L1抑制剂)治疗EGFR突变的非小细胞肺癌患者,不良反应中间质性肺病的发生率高达38%;吉非替尼联合德瓦鲁单抗治疗,3~4级肝酶升高的发生比例高达40%~70%。
按照现有的靶向治疗方案的疗效来看,EGFR突变(敏感突变)患者的缓解率有60%甚至更高。而这些患者,如果使用免疫治疗,钱也花了、药也吃了、罪也受了,疗效却完全不行。
2
先用靶向治疗、再用免疫治疗,效果如何?
那么,如果患者对以往的EGFR抑制剂治疗耐药,之后再选择免疫治疗,效果会不会也不理想呢?
事实上也不完全是。
如果患者已经明确地不再存在EGFR突变,并且还有一些能够从免疫治疗当中获益的指征,那么免疫检查点抑制剂也不失为一种治疗选择。
在一个案例当中,患者是肺腺癌,从最初EGFR ex19del突变使用吉非替尼,到耐药后出现EGFR T790M突变是使用奥希替尼,最终因KRAS外显子3(R68S)突变阳性而耐药。患者后续的治疗选择了白蛋白紫杉醇+纳武单抗(纳武利尤单抗),4个周期的治疗后,达到了临床部分缓解!

这说明,在部分非常特殊的情况下(EGFR抑制剂耐药后,EGFR转为阴性),免疫检查点抑制剂也能够成为这部分患者的选择。
不特殊的情况也有,另一款在研新药的临床试验来得更直接。
AK112(依沃西,Ivonescimab),一款PD-1/VEGF双特异性抗体,这款药物目前已经获得的突破性疗法称号当中有这样一个:联合化疗,共同治疗先前使用EGFR抑制剂治疗失败的EGFR突变的局部晚期或转移性非鳞非小细胞肺癌患者。
这款药物治疗先前接受过铂类化疗及抗PD-1治疗失败的非小细胞肺癌患者的试验组当中,患者的整体缓解率为40.0%,疾病控制率为80.0%。本组患者的中位无进展生存期为6.6个月,6个月无进展生存率为51.1%。
AK112+化疗的方案,其实相当于免疫+靶向(抗血管)+化疗的组合。患者还有EGFR突变,使用的治疗方案中却没有EGFR抑制剂,但最终的疗效还是很可观的。
相信大家已经抓到重点了:对于EGFR抑制剂耐药的EGFR突变患者(甚至是靶向治疗耐药的驱动基因突变患者),免疫+靶向(抗血管)+化疗的三联方案是可能有效的!具体效果怎么样呢?让我们一起看下面这三项试验。
1
阿特珠单抗+贝伐珠单抗+卡铂+紫杉醇
IMpower150试验纳入了曾经接受过至少一个靶向治疗方案的EGFR突变/ALK重排的非鳞非小细胞肺癌患者,这些患者接受阿特珠单抗(一款PD-L1抑制剂)+化疗(卡铂+紫杉醇)+贝伐珠单抗治疗的中位总生存期最长,26个月生存率超过60%,而仅接受化疗的患者中只有50%的患者生存期超过17.5个月;中位无进展生存期也有明显的延长(9.7个月 vs 6.1个月)。
根据2020年AACR年会上公开的数据,这项试验同样对比了免疫+化疗与化疗+抗血管、即阿特珠单抗+化疗与化疗+贝伐珠单抗两种联合治疗方案之间的疗效差异。结果显示,这两种方案治疗的患者总生存期之间差别不大。
显然,只有当三类药物共同应用时,才能收获最大的益处。
2
特瑞普利单抗+培美曲塞+卡铂
而另一项使用特瑞普利单抗联合培美曲塞+卡铂治疗EGFR抑制剂耐药且非T790M突变的患者的Ⅱ期研究中,免疫方案的缓解率达到了55.3%,疾病控制率92.1%。
3
阿特珠单抗+贝伐珠单抗+培美曲塞+卡铂
近期公开数据的一项由香港研究者完成的研究,基本复刻了IMpower150试验的结构,使用阿特珠单抗+贝伐珠单抗+培美曲塞+卡铂的方案,治疗EGFR/ALK基因突变且在多线靶向治疗之后耐药患者。
两项试验的结果也比较相似。,本项试验中患者的整体缓解率为62.5%,中位无进展生存期9.4个月,1年生存率72.5%;在临床试验用药方案耐药后,患者再次使用包含EGFR抑制剂的方案,中位无进展生存期仍然能达到5.8个月。
研究者表示,进行了少量改善(将紫杉醇改为培美曲塞)之后,在保证方案疗效的同时,治疗副作用有一定的减少。
看来免疫治疗究竟能不能用,还要根据实际情况来判断。尤其是免疫+化疗+靶向(抗血管)的多药联合方案,根据目前多项研究的结果来看,非常有潜力扭转PD-1抑制剂在EGFR突变患者中的劣势。
3
不考虑突变类型,靶向治疗耐药后,免疫治疗的疗效如何?
在一项回顾性分析(IMMUNOTARGET试验)当中,研究者分析了使用免疫检查点抑制剂单药方案,治疗携带至少1种致癌驱动基因突变的晚期非小细胞肺癌患者的疗效。
当然,最后的疗效并不理想,免疫疗法非常的“低效”。回顾性分析当中纳入的患者案例数量共551例,整体缓解率仅有19%,中位无进展生存期为2.8个月,中位总生存期13.3%。换句话说,仅仅一年零一个月之后,就已经有超过半数的患者死亡了。
如果根据患者的基因突变类型分组,疗效比较好的是KRAS突变的患者(271例),整体缓解率26%,中位无进展生存期3.2个月,中位总生存期13.5个月;EGFR突变的患者(125例)疗效比较差,整体缓解率仅13%,中位无进展生存期2.1个月,中位总生存期10.0个月;ALK、RET、HER2阳性的患者得到的疗效更差。
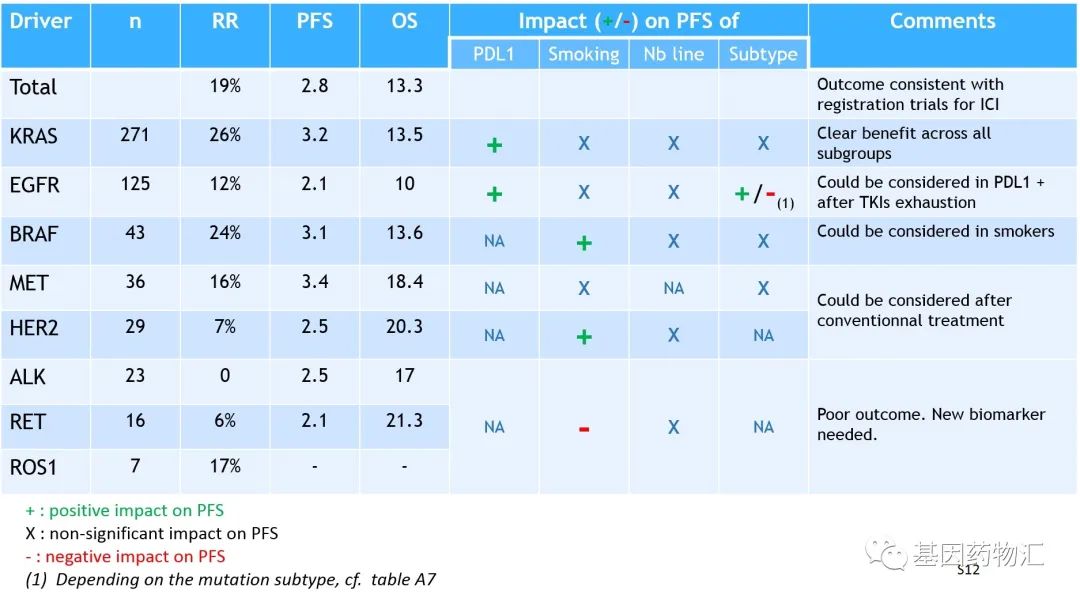
我们可以从结果中看出,BRAF、MET、KRAS突变的患者对于免疫治疗的响应率比较高,缓解率在15%~25%左右;HER2、EGFR、ALK、ROS1和RET这些突变类型的患者,对免疫治疗的响应率比较低,缓解率在10%左右,甚至为0。
所以说,如果这些突变型的患者因种种原因无法接受现有药物的治疗,那么相对更好的选择并不是去“盲试”免疫药,而是在专业医生或医学顾问的指导之下,尝试合适的临床试验。
哪些突变的患者适合接受免疫治疗,哪些不适合?
首先我们已经知道,大部分驱动基因突变阳性的患者,都不推荐使用免疫检查点抑制剂(单药)治疗。这一方面是因为疗效不够理想(与对应的靶向治疗方案相比),另一方面是因为副作用更严重,发生“爆发进展”的风险更高。
包括我们国家的CSCO指南在内,各类权威指南都不推荐驱动基因阳性的非鳞非小细胞肺癌患者使用免疫检查点抑制剂。NCCN指南中则是将EGFR/ALK/ROS1/BRAF等常见驱动基因突变作为“除外”的标准。
那么具体来说,哪些突变的患者适合接受免疫治疗、哪些患者不适合呢?

1
这些基因突变,敏感!
携带POLE/POLD1基因突变、BRCA/ATM/P53基因突变、MSI相关基因突变、CDK12基因缺失、PBRM1基因突变的患者,使用PD-1抑制剂,疗效较好。
POLE/POLD1
一项由中山大学徐瑞华教授团队完成、发布于顶级医学期刊《JAMA Oncology》杂志上的研究中指出,携带POLE/POLD1基因突变的患者,使用PD-1抑制剂的疗效更好。
根据研究的结果,同样接受免疫治疗,存在POLE/POLD1基因突变的患者中位总生存期为34个月,不存在POLE/POLD1基因突变的患者仅有18个月。即使排除掉其中合并了MSI-H的患者,生存期的优势仍然非常显著(28个月 vs 16个月)。
CDK12
CDK12在维持细胞基因组的稳定方面有独特的作用。从机理上来说,CDK12的缺失可能导致DNA损伤修复基因表达沉默,造成细胞处于与损伤修复基因缺陷相同的状态。
部分试验已经证实了CDK12基因缺失的患者能够对PD-1抑制剂产生更好的响应。例如根据一项发布于2019年ESMO大会上的报告,CDK12基因缺失的前列腺癌患者,4~6线使用PD-1抑制剂治疗(包括派姆单抗及纳武单抗)的前列腺特异性抗原反应发生率为38%,中位无进展生存期6.6个月。
2
这些基因突变,耐药!
存在JAK1/2或B2M突变的患者,对PD-1抑制剂耐药。
根据涵盖了黑色素瘤、结肠癌等多类癌症的多项临床试验分析,JAK1/2被确认为PD-1抑制剂的耐药突变之一。这两类基因改变在癌症患者中的占比并不算少,例如在黑色素瘤患者的统计结果中,JAK1和JAK2异常的占比分别在6%和11%左右。
3
这些基因突变,低效!
存在EGFR/ALK敏感突变、MET外显子14跳跃突变、SKT11功能缺失突变、PTEN功能缺失突变等的患者,使用PD-1抑制剂治疗的效果并不理想。
ATLANTIC试验是第一个验证免疫检查点抑制剂治疗EGFR/ALK阳性患者疗效的前瞻性研究,111例EGFR/ALK阳性患者中PD-L1 TPS≥25%的比例高达66.7%,但免疫检查点抑制剂治疗的缓解率仅有12.2%。
显然,这样的疗效并不能令人满意。如果找不到一些更好的免疫联合方案,那么这部分患者与其使用免疫治疗,还不如选择疗效更好的靶向治疗,甚至化疗方案。
4
这些基因突变,警惕爆发进展!
存在MDM2/MDM4基因扩增、EGFR基因扩增、CND1/FGF3/FGF4/FGF19等(11号染色体13区带相关基因)扩增的患者,接受PD-1抑制剂治疗,可能出现爆发进展,甚至危及生命!
接受PD-1抑制剂治疗后第一次复查CT时就出现了进展,肿瘤病灶增大超过50%,且生长速度加快超过50%,就被称为“爆发进展”。不过,如果患者在继续接受相同治疗的情况下肿瘤转而缩小,那就会被归入“假进展”的分类中。
就目前的临床统计结果,接受PD-1/PD-L1抑制剂治疗后出现爆发进展的风险,大约在10%~15%左右。部分统计研究的结果显示,发生爆发进展的患者,生存期明显短于其他患者(3.4个月 vs 17个月)。
目前的临床研究已经确定了一些会导致爆发进展的风险突变,包括MDM2/MDM4基因扩增,EGFR基因扩增,CCND1/FGF3/FGF4/FGF19等(11号染色体13区带相关基因)扩增等。如果患者符合上述突变类型,那么在选择免疫治疗的时候一定要足够谨慎小心。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)