2022-11-25 来源 : 瞪羚社 ,作者Kris.
恒瑞医药的海外战略进展,似乎出现了超预期的迹象。
11月21日,恒瑞医药发布公告:公司向美国 FDA 申报的钆布醇注射液ANDA(美国仿制药申请)已获得批准。

钆布醇注射液是一款造影剂,在国内乃至全球都有不俗的市场规模,全球相关剂型的销售约4.95亿美元。
值得注意的是,美国市场除原研产品外,恒瑞医药该获批产品为为首仿药;据美国竞争性仿制药疗法法案,将获得180天市场独占期。
市场投资者可能会发出疑问:“虽然在美国获批,但终究是仿制药;诸如在美国获得大量注射剂ANDA批文的健友股份,在国内也仅仅只有15-20倍市盈率的估值。亮点在哪里?”
恒瑞医药在美国仿制药的申请&获批,今年出现加速迹象。
2020年以前,恒瑞医药获FDA批准的品种有14个,其中有10个注射剂。2020-2021年间,恒瑞医药仅获得2个注射剂ANDA批文。

今年,恒瑞医药造影剂仿制药ANDA出现井喷,4-5月公司的钆特酸葡胺注射液、碘克沙醇注射液ANDA也先后获FDA批准。
值得一提的是,碘克沙醇注射液同样成为美国市场的首仿药,享受180天市场独占期;数据显示,碘克沙醇注射液相关剂型全球销售额约为8.73亿美元,恒瑞医药国内碘克沙醇注射液销售额一度超过30亿元。
截止目前,恒瑞医药在碘克沙醇注射液项目上投入接近1亿人民币。凭借着市场独占期红利、首仿地位,恒瑞医药有望迅速收回研发成本。

(时间截止2022年4月)
2018-2021年,恒瑞医药海外收入均在6-8亿人民币区间徘徊,占总收入比重不超过5%。
目前正值恒瑞医药受仿制药集采影响的低谷期,随着更多的仿制药大单品海外获批,在帮助恒瑞医药对冲国内集采压力同时,帮助公司重回季度业绩正增长。
海外仿制药品种增加,对于恒瑞未来国际化,裨益丰富。
美国cGMP认证要求高、规范性更强,国内能通过的药企较为稀缺,药企如果一旦打通ANDA申请路径,有机会迅速复制到其他品种。恒瑞医药仿制药的“探路”,无疑为未来公司创新药出海提供了夯实的基础。
销售渠道层面,在美国药品销售体系复杂,最大支付方实际上是商业保险,美国患者购买一种药物,牵扯的利益群体不单单是制药商、批发商、药房,还包括医生、药房福利管理机构(PBMs)等。
在PBMs体系和商业保险主导的背景下,在美国销售药品的药企与下游终端GPO、IDN/PN、零售商三大渠道保持良好关系至关重要;因为注射剂主要销售给医疗机构,所以主要面向服务医疗机构和医疗团体的GPO、IDN/PN,通过招投标的形式获取市场。
以健友股份为例,2019年收购了本土专注仿制药注射剂产品的Meitheal Pharmaceuticals,一方面丰富自身自身ANDA管线&强化申报能力,另一方面则是看中了该公司的终端客户资源与GPO、大型零售企业良好的关系。
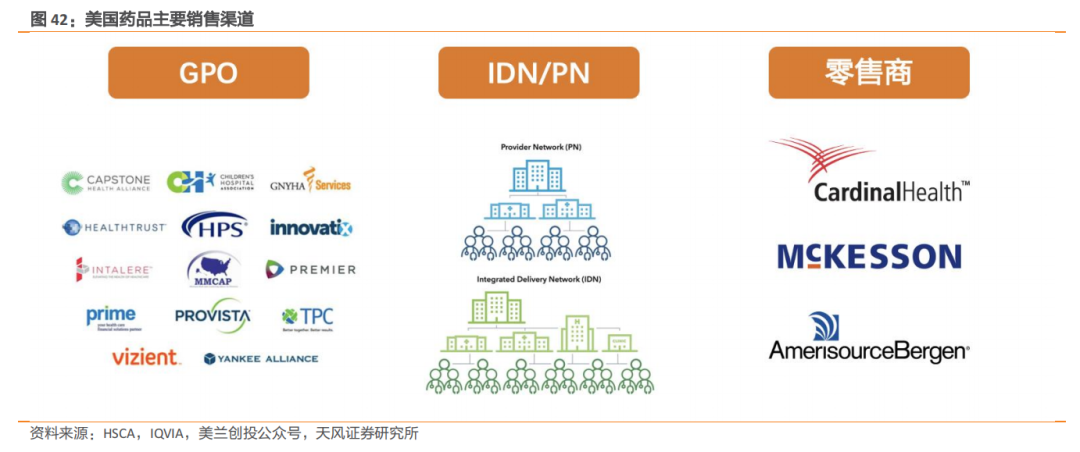
公开信息中,恒瑞医药尚未明确海外销售模式。最新数据显示,恒瑞医药在美欧两地已经建立了涵盖医学科学、临床运营、注册、药理、统计、质量管理临床研发团队共计170余人。
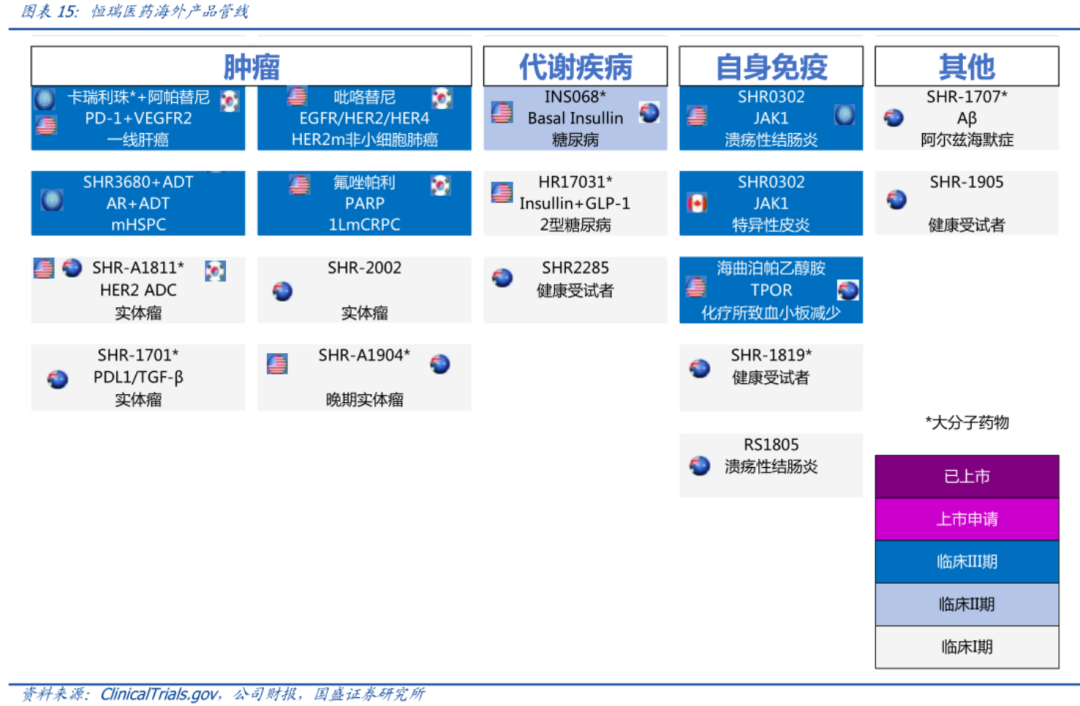
参考百济神州,PD-1、TIGIT均授权给MNC诺华,却将最有潜力的单品BTK留下孵化自身全球销售团队,让人看到了其成为Big Pharam的野望。
相信恒瑞医药也有属于自己的Big Pharam梦,只是暂缺一款潜力的大单品。
今年5月成立的海外子公司Luzsana虽然背靠恒瑞医药庞大研发团队、选取超过11个高潜力项目,单就目前公司已经进入三期的临床管线分析,迎来海外创新药收入的井喷仍然需要等待和积累,处于三期临床的PD-1、PARP、JAK1、TROP等靶点管线除了审批具有不确定性外,在美国是否能打市场也存在很大疑问。
不过,恒瑞医药的业绩拐点可能要比想象中更快到来。
除了预计2023年上半年恒瑞医药有望将仿制药的影响大部分出清外,新获批的创新药面临医保谈判、仿制药出海顺利、团队精简&股权激励等多因素的补充,都能够加速公司回到业绩增长的正轨,进而反哺创新投入。
结语:这,也可能是恒瑞医药股价近期比大多数上市药企走得更稳的核心原因。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)