导语:近日,美国食品药品监督管理局(FDA)和疾病控制与预防中心(CDC)指控Moderna在其二价新冠疫苗的批准过程中隐瞒数据。FDA和CDC多名顾问表示:“对Moderna的这一行为表示愤怒和失望!为了获得纳税人的50亿美元订单,Moderna隐瞒了接种二价疫苗的研究参与者中有3.2%被感染,而接受一价疫苗的参与者中只有1.9%被感染的事实数据。在这件事情上,Moderna和FDA均有不可推卸的责任。”目前,Moderna和FDA的发言人对究竟是谁对数据遗漏负责存在分歧。
对于要获得批准的新疫苗,FDA和CDC都必须召集他们的顾问委员会,并向顾问小组进行介绍。然后,这个客观审查小组将投票决定是否让新疫苗通过批准。这些独立顾问包括来自斯坦福大学、宾夕法尼亚大学和哈佛大学的传染病专家和疫苗学家,但他们现在表示对Moderna在其二价疫苗获批的讨论中向他们展示的部分信息表示担忧。在今年6月的FDA会议和9月的CDC咨询小组会议上,Moderna二价疫苗数据表明新的二价疫苗比一价更有效。这些结果均基于实验室测试:从二价疫苗接种者身上提取的血液暴露于Omicron,然后与接种一价疫苗的人的样本进行比较,以衡量每种疫苗在对抗新冠病毒抗体方面的效果。然而,同一研究的其他数据并未提交给小组,这些数据反映了实际感染情况。隐瞒的数据表明,接种二价疫苗的研究参与者中有3.2%被感染。相比之下,接受一价疫苗的参与者中只有1.9%被感染。但是,FDA给顾问们的22页简报文件没有提到这一感染数据。FDA疫苗研究与审查办公室病毒产品司司长Jerry Weir博士在向顾问介绍时也没有提及感染数据。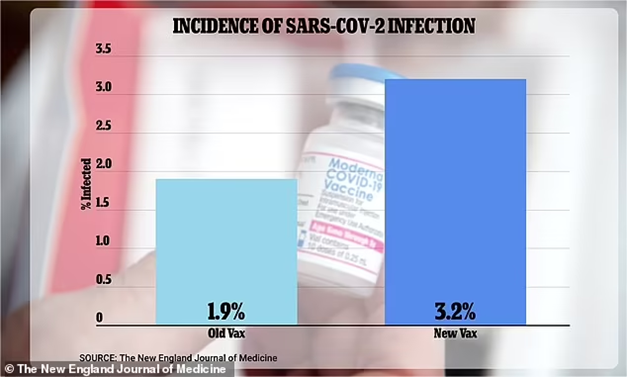
图1 Moderna二价疫苗真实感染数据(图源:[1])Moderna和FDA的发言人对究竟是谁对数据遗漏负责存在分歧。Moderna发言人Christopher Ridley表示:“在FDA要求Moderna提供正在进行的研究的最新数据后,Moderna在FDA小组6月会议之前已与FDA分享了感染数据。该研究于6月25日也就是专家组开会的三天前,作为预印本公开发布在网上。”然而,FDA发言人Michael Felberbaum表示:“FDA在咨询委员会会议召开前不到一天才收到预印本,此时该预印本的审查和纳入该机构的会议材料为时已晚。”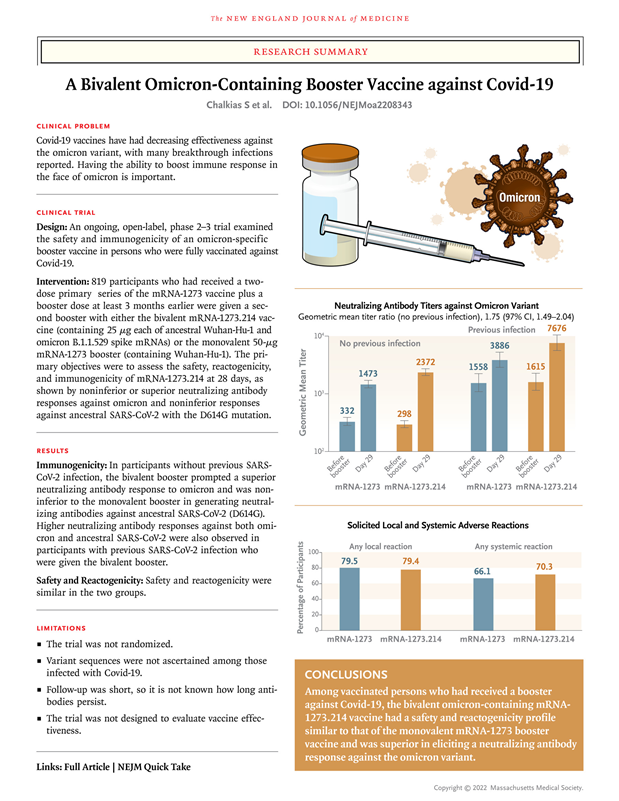
图2 Moderna二价疫苗临床2/3期数据(图源:[2])Moderna的高级副总裁Jacqueline Miller博士被指控在9月份向CDC顾问做报告时采用“精心挑选”的材料。当专家组的一名成员明确询问接种一价疫苗的人与接种二价疫苗的人感染新冠病毒的情况时,Miller博士却给出了不完整的回答。Miller博士引用了那些有或没有先前感染证据的人的疾病发病率,这从更积极的角度凸显了二价疫苗的效力,但是没有提到以前没有感染过新冠病毒的数百名研究参与者的发病率,因为这些数据显示一价疫苗接种在预防感染方面明显更有效。FDA疫苗咨询委员会成员Eric
Rubin博士表示:“我们的顾问不是一群小孩,没那么容易糊弄,他们知道如何解释这些结果。”六名FDA和CDC顾问表示,Moderna隐瞒的感染数据并不会改变他们的投票方式,因为这些数据有一定的局限性,但Moderna仍然应该将完整数据呈现给顾问。顾问们认为Moderna没有向他们提供的感染数据很重要,主要有三个原因:第一,他们做出的决定具有潜在影响力,如果美国人要接种这些疫苗,所有可用的数据都应该摆到桌面上供评估;第二,咨询委员会会议是在线直播的,世界各地的监管机构会参考这些信息,做出有关本国疫苗的决策;第三,对于公众来说透明度很重要,这关系到FDA的公信力。公众看不到FDA官员之间或机构官员与制药公司高管之间的对话,但他们确实可以观看咨询小组的会议记录。如果在顾问会议上讨论所有数据,而不仅仅是部分数据,才会让公众感到安心。密歇根大学公共卫生学院流行病学教授兼FDA顾问小组代理主席Arnold Monto博士表示:“Moderna应该始终保持数据完全透明,不应忽视这些数据。虽然只是早期数据,但结果表明我们需要研究它们,衡量它们的价值。”CDC小组成员Pablo Sanchez博士称:“免疫实践咨询委员会表示,如果数据作为研究的一部分进行审查,则应该在他们做出决定之前将其提交给顾问。”FDA发言人Michael
Felberbaum表示:“FDA在咨询委员会会议前不到一天才收到预印本。因此,该信息没有在足够的时间内提供,无法将其纳入FDA的会议材料,通常FDA只在咨询委员会会议上讨论该机构有机会进行实质性审查的数据。新冠疫苗仍然是抵御新冠重症的最佳方法,并且升级后的疫苗可能有助于更好地保护当前流行的变种病毒。在整个大流行期间,FDA在新冠疫苗的流程和决策方面尽可能保持透明,Moderna本可以选择在FDA咨询委员会会议前提交数据。”
二价mRNA疫苗:无法增强BA.4和BA.5中和抗体滴度
鉴于mRNA技术对变异毒株快速做出反应的能力,双价疫苗应运而生。2022年1月和2022年2月,辉瑞-BioNTech生产了一种二价疫苗,其中含有15μg针对新冠祖先毒株的mRNA和15μg针对BA.1的mRNA。Moderna使用了25μg mRNA,分别针对相同的两种毒株。2022年6月28日,来自辉瑞–BioNTech和Moderna的研究人员向FDA的疫苗和相关生物制品咨询委员会提交了有关其二价疫苗的数据。结果令人失望:二价加强剂导致针对BA.1的中和抗体水平仅为单价疫苗的1.5至1.75倍。经验表明,这种差异不太可能具有临床意义。与此同时,BA.1已不在美国流通,取而代之的是更具免疫逃避性和传染性的Omicron亚变体。但是,凛冬已至,Omicron的传播加速,为应对这些免疫逃避毒株,FDA咨询委员会决定通过审核。随后,一系列的政策接踵而至。2022年6月29日,即咨询委员会会议后的第二天,拜登政府同意以32亿美元购买1.05亿剂辉瑞-BioNTech二价疫苗。2022年7月29日,政府同意以17.4亿美元购买6600万剂Moderna的二价疫苗,并打算在秋冬两季提供这两种疫苗。2022年9月1日,FDA撤销了对单价疫苗加强剂的紧急使用授权,CDC建议12岁或以上的所有人使用二价疫苗加强剂。2022年10月12日,CDC将此建议扩大到包括所有5岁或以上的人。但是,此时没有来自人类的数据,包括免疫原性数据。2022年10月24日,David Ho及其同事发布了一项接受单价或二价加强剂量后针对BA.4和BA.5的中和抗体水平的研究。他们发现两组之间“对任何新冠变体的中和没有显著差异”。一天后,Dan Barouch及其同事发布了一项类似研究的结果,发现“在接种单价和二价mRNA增强剂组中,BA.5中和抗体滴度差别不大。” Barouch及其同事还注意到,单价疫苗和二价加疫苗接种参与者之间的CD4+或CD8+T细胞反应没有明显差异。两个研究小组都没有发现二价疫苗能引发更好的免疫反应[4]。在FDA顾问会议召开六个月后,Moderna尚未发布另一项有3,000名参与者参与的随机3期试验的数据,该试验比较了二价疫苗接种者与一价疫苗接种者的感染情况。Moderna的二价疫苗于8月底向所有12岁以上的美国人开放,但是接种率非常低。根据FDA的数据,只有15.4%的美国人口接受了二价疫苗,相比之下,约70%的人接受了一价疫苗接种。即使在风险最高的年龄组(65岁及以上)中,也只有38%的人选择接种二价疫苗。这种较低的接种率,归因于担心疫苗开发和批准过程缺乏透明度,FDA顾问最近提出的这些指控可能会进一步加剧这种担忧。[2]Chalkias S, Eder F, Essink B,et al. Safety, immunogenicity and antibody persistence of a bivalent Beta-containing booster vaccine against COVID-19: a phase 2/3 trial. Nat Med. 2022 Nov;28(11):2388-2397. doi: 10.1038/s41591-022-02031-7. Epub 2022 Oct 6. PMID: 36202997; PMCID: PMC9671805.[3]Offit PA. Bivalent Covid-19 Vaccines - A Cautionary Tale. N Engl J Med. 2023 Jan 11. doi: 10.1056/NEJMp2215780. Epub ahead of print. PMID: 36630616.
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。







发表评论
注册或登后即可发表评论
登录注册
全部评论(0)