2023-11-03 来源 : 华创新药
一、IO市场超400亿美元,联合化疗提升临床和商业价值
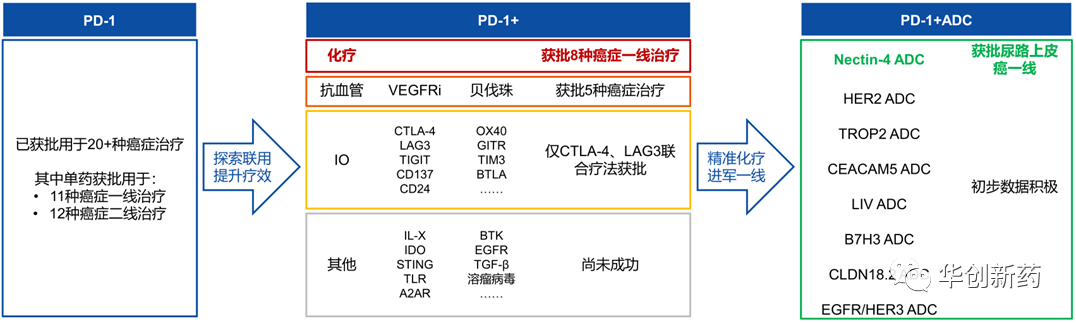
PD-1/L1单抗作为广谱免疫抑制剂,在一系列肿瘤中取得了阳性临床结果,开启了肿瘤免疫(IO,Immuno-Oncology)时代。FDA先后批准了5款PD-1单抗和3款PD-L1单抗,以及2款CTLA-4单抗。2022年,海外IO疗法总销售额近400亿美元。NMPA批准了11款国产PD-1/PD-L1单抗以及1款PD-1/CTLA-4双抗,样本医院数据显示销售额持续增长。
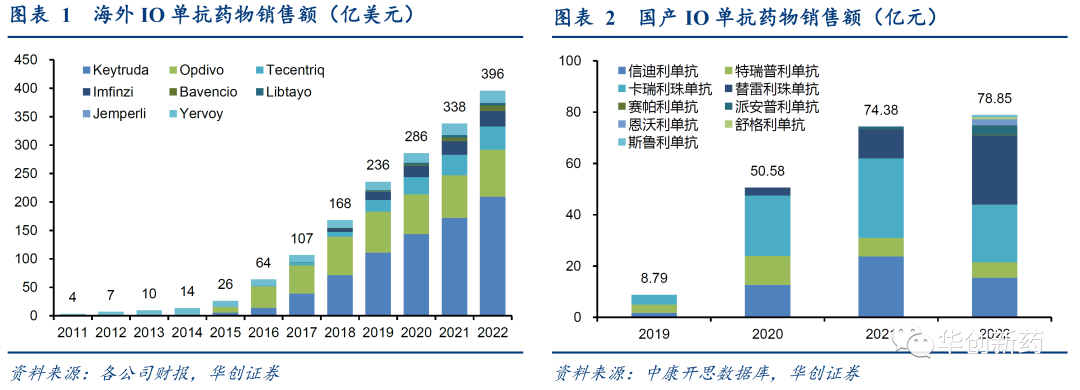
尽管PD-1/L1单抗已获批用于20多种癌症治疗,然而仅在少数瘤种(如cHL、黑色素瘤)中应答较好,多数实体瘤中PD-1/L1单抗ORR在10-30%之间,能够从PD-1/L1单抗获益的患者始终是少部分。因此,提高PD-1/L1单抗的应答率、延长应答时间,意味着更大的临床和商业价值。
过去5-10年,工业界穷举尝试了数千种IO联合不同机制的药物临床试验,包括+化疗、+抗血管、+IO疗法、+细胞因子、+靶向药等。
(一)IO+化疗:疗效显著提升,全面成为一线疗法
对比化疗或者PD-1单药,PD-1+化疗能够显著提升患者临床疗效。
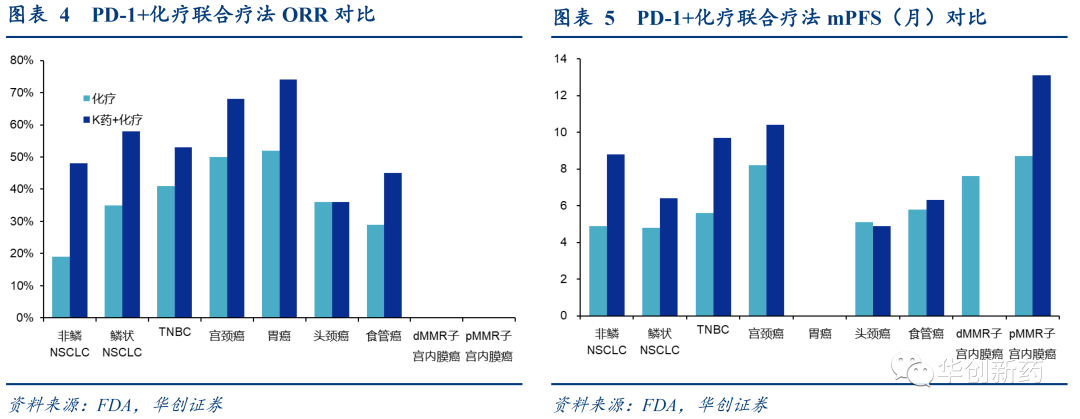
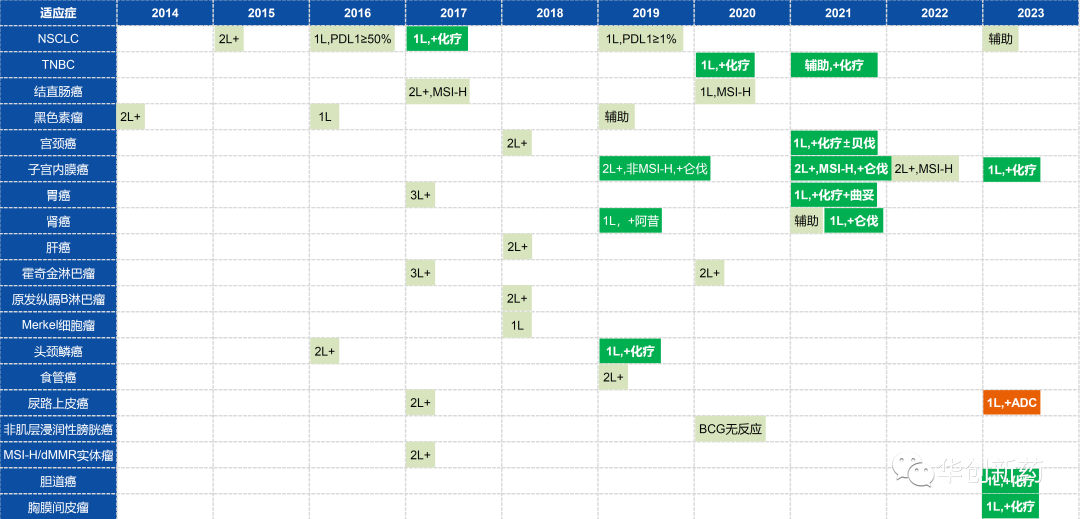
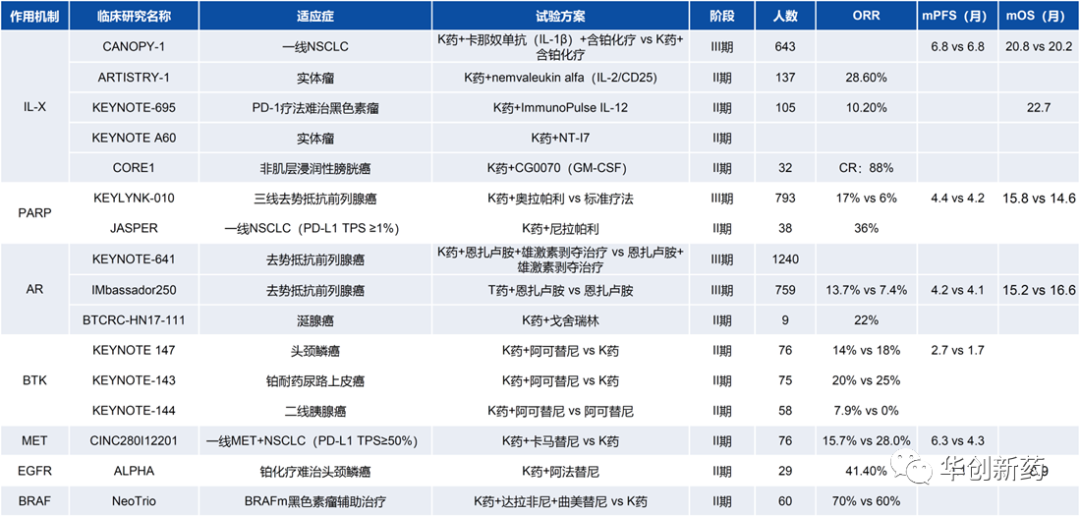
Keytruda+化疗已经获批用于NSCLC、TNBC、宫颈癌、胃癌、头颈癌和食管癌等癌症的一线治疗,在子宫内膜癌、胆管癌、胸膜间皮瘤的临床III期也已达到终点,正在与监管机构沟通上市。
从Keytruda适应症获批以及III期成功的时间轴来看,一线联合化疗逐步替代了二线单药方案。
(二)IO+抗血管:少数适应症成功,不良反应限制临床潜力
肿瘤免疫反应与肿瘤血管生成的相关通路存在相互影响,通过靶向阻断肿瘤微环境中的VEGF(R),不仅能抑制肿瘤血管的生成、肿瘤生长和肿瘤转移,而且可以激活一部分免疫细胞,使更多的免疫细胞浸润至肿瘤组织中。目前,PD-1+抗血管联合疗法在5个癌种中获批,但扩展空间有限,在尿路上皮癌、卵巢癌等适应症中失败,甚至在此前成功的适应症如肝细胞癌中,当仑伐替尼作为对照时也未能成功。部分失败的临床研究中联合疗法提升响应率并延长了中位PFS,在中位OS上最终获益并不显著。
同时,PD-1+抗血管联合疗法不良反应也更为严重,患者停药比例高,长期获益受到影响。
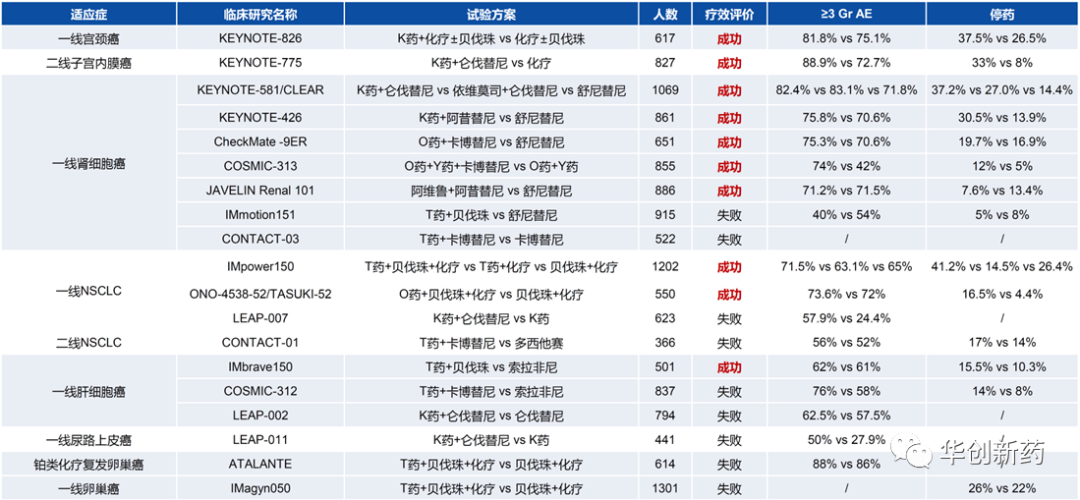
(三)IO+IO:仅2个靶点药物获批,疗效提升有限
随着PD-1单抗取得巨大成功,寻找新的肿瘤免疫疗法成为最热门的研发方向,一批肿瘤免疫靶点管线迅速推进研发。
在2017年JPM大会上,BMS曾宣布全面布局肿瘤免疫,将各类IO相关的新靶点药物推进临床,包括CD137、OX40、Lag3、TIGIT、TIM3等。至今,仅有CTLA-4和LAG3单抗获批与PD-1联合治疗肿瘤。
1、PD-1+CTLA-4:疗效有所提升,安全性较差
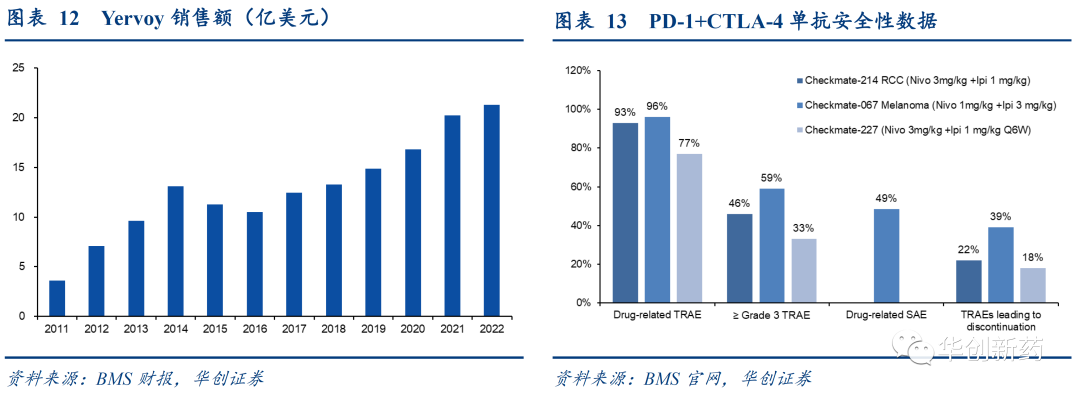
BMS的O+Y组合验证了PD-1+CTLA-4的疗效,已获批适应症包括:1L黑色素瘤、1L NSCLC、1L肾癌、MSI-H/dMMR
CRC、2L肝癌、1L胸膜间皮瘤等。
然而,由于安全性问题,Yervoy临床应用受限,2022年销售额仅20亿美元。
当前多种新一代CTLA-4药物正在进行研发,降低不良反应有望进一步拓展应用空间。
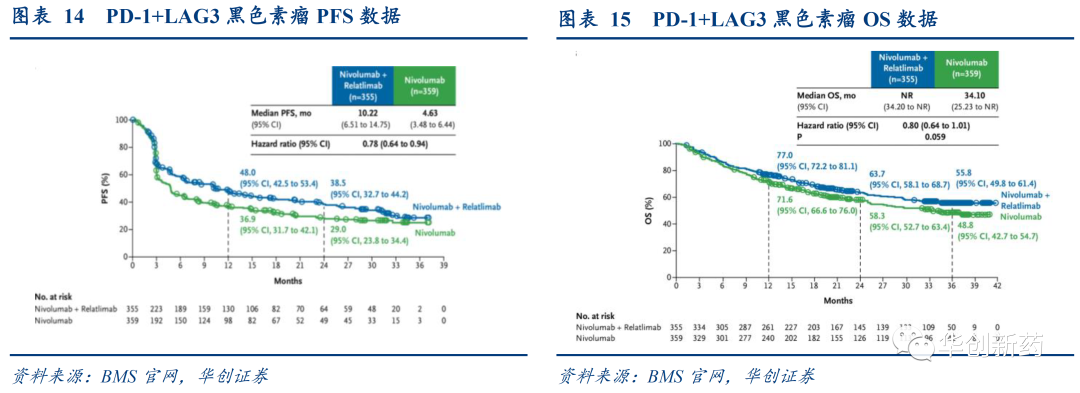
2、PD-1+LAG3:仅获批用于黑色素瘤治疗,OS获益不显著
LAG3单抗治疗效果有限,通过与PD-1单抗联用在黑色素瘤中展现积极疗效。
BMS的LAG-3单抗Relatlimab已经获批上市。Relatlimab联合O药对比O药单药一线治疗不可切除黑色素瘤的III期结果积极,Relatlimab联合O药治疗组为10.12个月,O药单药治疗组为4.63个月。OS获益显示出延长趋势,但没有统计学意义。
3、PD-1+TIGIT:中期分析数据不佳,希望尚存但潜力有限
TIGIT是当前最被寄予厚望的IO新靶点,多项III期试验正在进行当中。
默沙东的Vibostolimab(TIGIT单抗)早期数据积极,但近期MK-7684A(K药+Vibostolimab复方制剂)治疗免疫治疗和双铂化疗治疗后疾病进展的转移性NSCLC的临床II期试验结果显示,MK-7684A单药相比多西他赛在PFS的主要终点上未达到具有统计学意义的差异,并且在数值上与多西他赛相比效果较差。
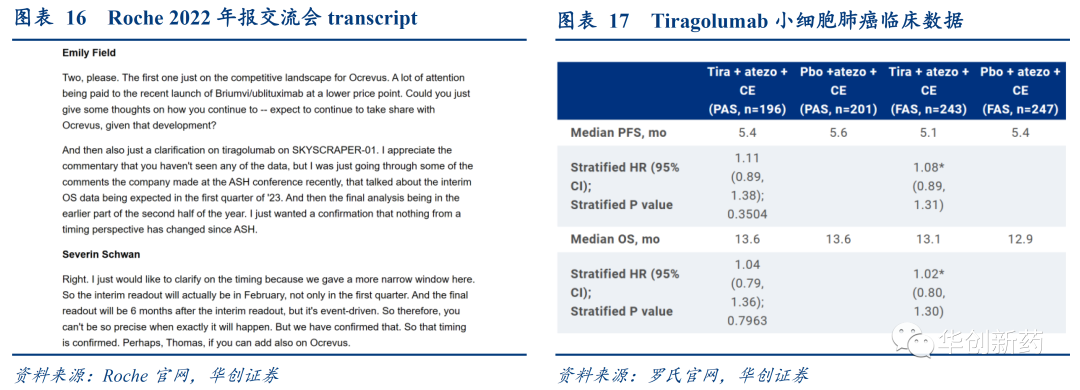
罗氏的TIGIT单抗Tiragolumab正在开展多项临床III期研究,在NSCLC、SCLC等适应症的中期分析均未取得阳性结果。2022年5月11日,罗氏公布了临床III期研究SKYSCRAPER-01的结果。该研究评估了tiragolumab联合Tecentriq®(atezolizumab)与Tecentriq在PD-L1高表达的局部晚期或转移性NSCLC患者一线治疗疗效。该研究未达到其共同主要终点之一PFS,另一共同主要终点OS尚未成熟,在两个共同主要终点中都观察到了数值上的改善。该研究将在2023下半年取得最终OS结果,仍然保留了最后的希望,但预计OS数据很难有较大的突破。
随着曾被寄予厚望的IO靶点未在临床研究中取得显著疗效,肿瘤免疫管线的研发热度有所消退。
2023年初,BMS再次更新了研发管线,此前布局的大多数IO疗法中仅LAG3单抗上市,TIGIT单抗、IL-8单抗仍在推进研发,其余管线已经终止。
(四)IO+其他:大多以失败告终
1、PD-1+IL-2激动剂:关键临床全面终止
2、PD-1+溶瘤病毒:临床III期未达终点
3、PD-1+IDO:关键临床已全部终止
4、PD-1其他联合疗法多以失败告终
二、IO+ADC:一线治疗数据积极,有望提升IO+化疗疗效
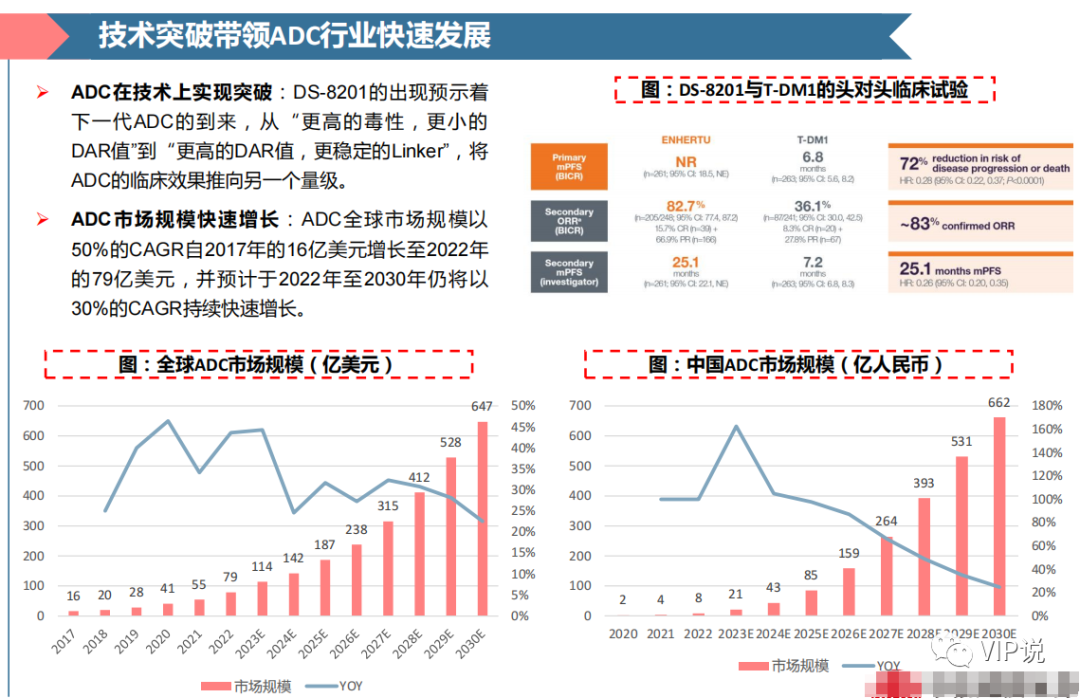
近年来,随着ADC技术的成熟,ADC作为一类“高效、靶向化疗”,正在显示出与PD-1/L1联用的潜力。
(一)PD-1+Nectin-4 ADC:一线治疗尿路上皮癌率先获批
Padcev是Seagen研发的Nectin-4 ADC,此前获批用于治疗PD-1经治的尿路上皮癌。2023年4月3日,FDA加速批准了Padcev联合K药用于尿路上皮癌患者的一线治疗,成为首个获批的PD-1+ADC疗法。
临床Ib/II期研究EV-103的队列K中评估了Padcev(EV)联合K药在先前未经治疗且不适用顺铂的局晚期或转移性尿路上皮癌患者中的疗效和安全性。截至2022年6月10日,共有149例患者入组接受治疗,其中EV+P组76人,EV单药组73人。两组确认的ORR分别为64.5%和45.2%。
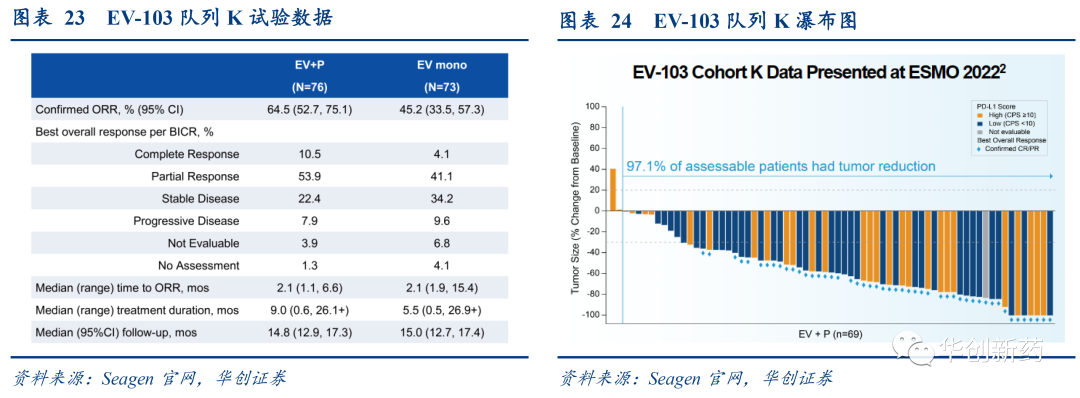
Padcev目前开展的四项注册临床均正在探索联合PD-1/L1单抗疗法的治疗潜力,除了尿路上皮癌的一线疗法外,还在探索用于膀胱癌新辅助或辅助疗法的疗效和安全性,有望将PD-1/L1联合Padcev推进更早期治疗阶段。
(二)PD-1/L1+TROP2 ADC:广谱潜力,市场巨大
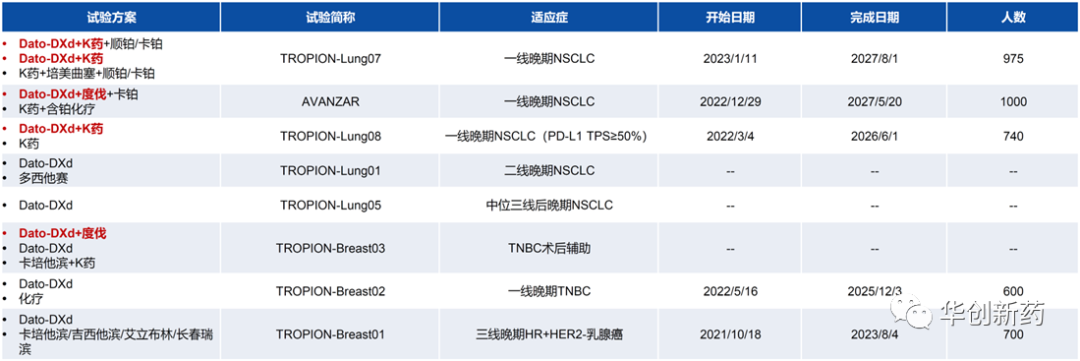
1、Dato-DXd+PD-1/L1:肺癌和三阴乳腺癌III期进行中
Dato-DXd是第一三共和阿斯利康合作研发的TROP2 ADC药物,单药在NSCLC、TNBC和尿路上皮癌后线治疗中展现积极疗效。
临床Ib期研究TROPION-Lung02评估了Dato-DXd+K药±含铂化疗在非驱动基因突变的NSCLC患者中的疗效和安全性。中期分析结果表明,Dato-DXd+K药(二联)和Dato-DXd+K药+含铂化疗(三联)疗法表现出积极疗效。整体耐受性良好,分别有40%和60%的患者出现3级及以上TEAE,共发生4例药物相关的ILD,其中2例1/2级,2例3级,未发生4/5级ILD。

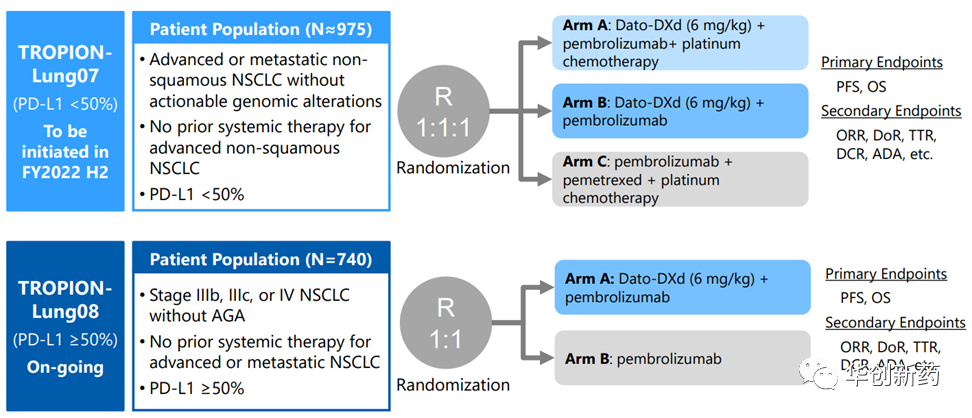
根据这些数据,第一三共启动了临床III期研究TROPION-Lung07和08,进一步评估Dato-DXd+K药一线治疗NSCLC患者的潜力。
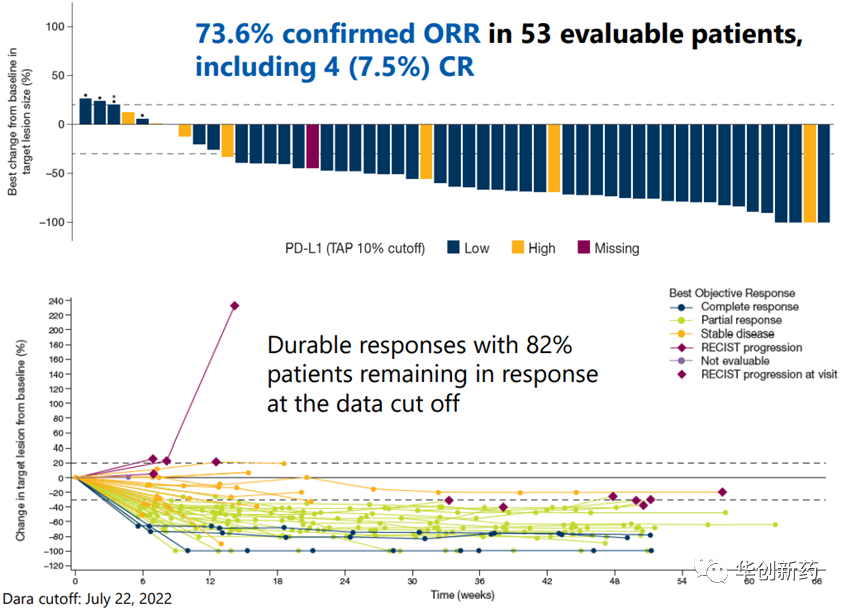
临床Ib/II期研究BEGONIA中评估了durvalumab(度伐利尤单抗)联合Dato-DXd用于a/mTNBC一线治疗的疗效和安全性。截至2022年7月22日,共有61例患者接受了Dato-DXd+D联合疗法,其中45例仍在接受治疗,中位随访时间为7.2个月。未发生DLT,3/4级AE发生率为41%。在53例可评估患者中,ORR为73.6%,包括4例(7.5%)CR,中位PFS未成熟。
对于Dato-DXd后续应用场景的拓展,阿斯利康和第一三共计划通过联用在肺癌和乳腺癌中拓展早线适应症。目前已经启动四项临床III期研究,在一线NSCLC和TNBC中探索Dato-DXd联合PD-1/L1单抗的治疗潜力。
2、Trodelvy+PD-1:尿路上皮癌数据积极
Trodelvy是吉利德旗下的TROP2 ADC,已获批用于HR+HER2-乳腺癌、NSCLC、尿路上皮癌的后线治疗。
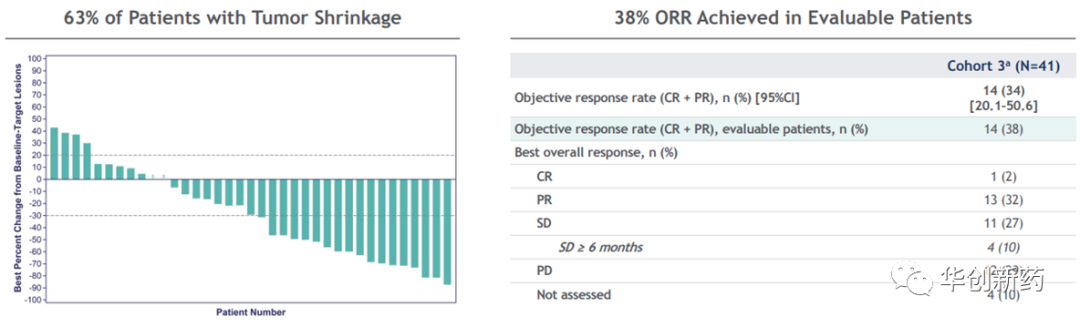
吉利德在一项临床II期研究TROPHY-U-01中评估了Trodelvy与Keytruda联用效果。这是一项国际多中心、开放标签、多队列、单臂研究,评估Trodelvy单药或联合疗法在未经CPI治疗且铂类化疗进展后mUC患者中的安全性和疗效。初步ORR达到38%。ASCO
GU2023年会更新的数据显示:中位随访时间达到12.5个月时,41例患者中ORR达到41%,中位DoR 11.1个月,中位PFS 5.3个月,中位OS 12.7个月。3级及以上的TRAE发生率61%,主要为血液毒性。
一项临床I/II期研究评估了在未经治疗且不适用铂类化疗的尿路上皮癌患者中Trodelvy+O+Y药一线疗法的安全性和疗效。该研究的I期剂量递增部分招募了9名患者。6名患者接受了8 mg/kg SG的剂量,并发生1例DLT;3名患者接受10 mg/kg的剂量,发生2例DLT。DLT包括3级皮疹(n=2)和3级肺炎(n=1)。最终SG的RP2D为8mg/kg,Y药和O药以3mg/kg和1mg/kg Q3W给药4个周期。最常见的TRAE包括贫血(66.6%)、中性粒细胞减少症(66.6%)和淀粉酶/脂肪酶升高(11.1%)。1例患者同时出现2级肺炎和肌肉组织炎症。在9名患者中,6名患者(4名接受8mg/kg SG,2名接受10mg/kg SG)可评估反应,ORR为66.6%,其中1例CR,3例PR。中位DOR为9.2个月,mPFS为8.8个月,未达到mOS。目前临床II期研究正在进行中。
吉利德目前正在探索Trodelvy+Keytruda作为TNBC术后辅助、TNBC和NSCLC一线疗法的潜力,已启动三项III期研究。

3、SKB264+PD-L1:一线治疗TNBC初步疗效积极
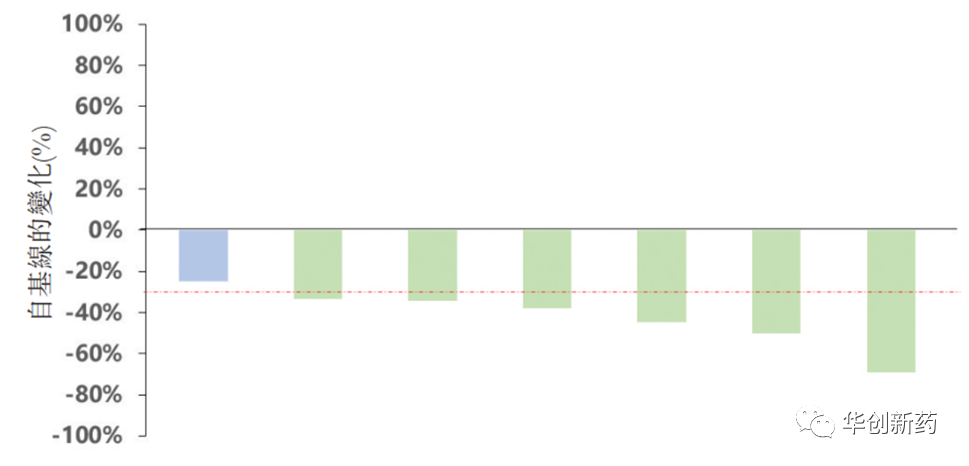
一项在未接受系统性治疗的晚期或转移性TNBC患者中进行的临床II期研究评估了SKB264单药疗法或联合A167的安全性、耐受性及初步抗肿瘤活性。截至2022年12月6日,共入组8名患者,其中7名可评估的患者接受了SKB264联合A167治疗,ORR为85.7%,DCR 100%。联合疗法耐受性良好,3名患者(37.5%)经历了3级或以上的TRAE,未发生药物相关的SAE。
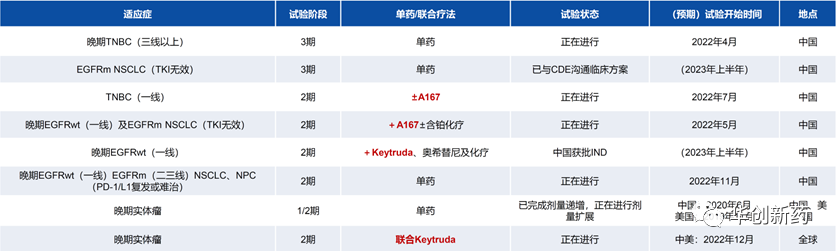
科伦博泰正在开展SKB264联合A167在NSCLC和TNBC中的临床研究。
此外,科伦博泰还与默沙东合作开展SKB264的全球1/2期试验及两项多区域2期篮子研究:1)SKB264联合Keytruda治疗选定实体瘤(包括复发或转移性CC、晚期UC、复发性OC和转移性前列腺癌),分别于2022年7月及2022年11月取得国家药监局及FDA的IND批准后于2022年12月在中国及美国开始研究;2)SKB264作为治疗晚期EGFR野生型及EGFR突变型NSCLC的联合疗法(包括Keytruda、奥希替尼及化疗),已于2023年1月取得国家药监局的IND批准。
(三)PD-1/L1+HER2 ADC:HER2阳性实体瘤全面布局
1、T-DXd+PD-L1:一线治疗TNBC ORR超过50%
T-DXd(DS-8201,Enhertu)是第一三共和阿斯利康合作研发的HER2 ADC,已获批乳腺癌、NSCLC、胃癌等适应症。
阿斯利康在临床Ib/II期研究BEGONIA中评估了度伐利尤单抗联合其他疗法用于a/mTNBC一线治疗的疗效和安全性。这是一项两部分开放标签研究,第一部分包括5个联用队列,第二部分为II期扩展阶段,包括Dato-DXd+D和T-DXd+D两个治疗组。截至2022年7月22日,两个部分共有58例患者接受了T-DXd+D联合疗法,其中28例仍在接受治疗,中位随访时间为13.4个月。未发生DLT,3/4级AE发生率为43.1%,主要为血液毒性。所有患者ORR为56.9%,包括1例(1.7%)CR,中位PFS为12.6个月。
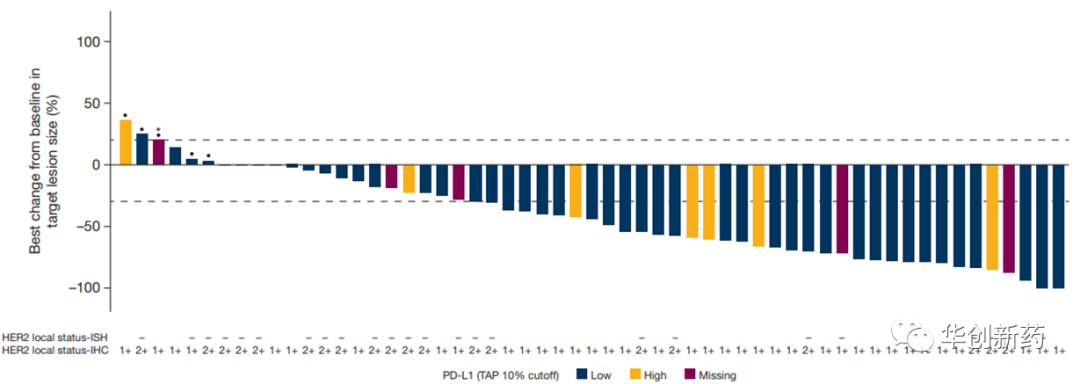
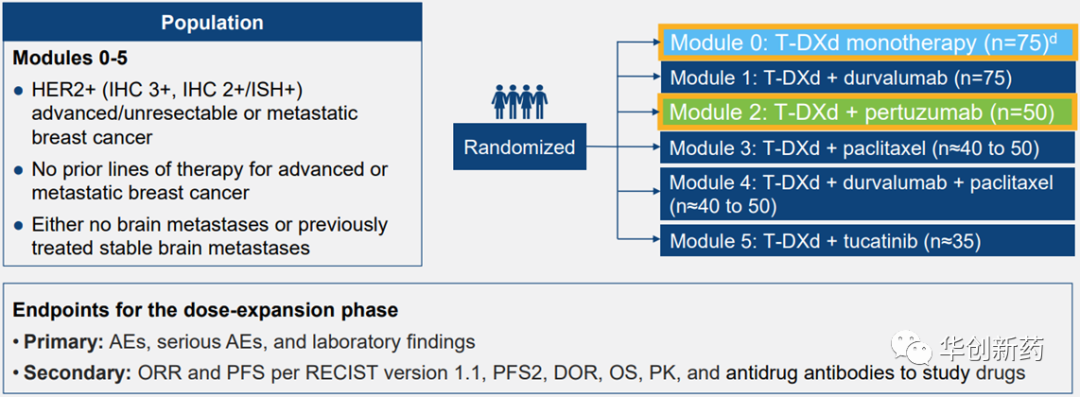
DESTINY-Breast07研究是在HER2阳性晚期乳腺癌中探索T-DXd单药或联合疗法疗效的一项Ib/II期研究,第一部分为剂量探索阶段,包括T-DXd+度伐利尤单抗、帕妥珠单抗、紫杉醇、度伐利尤单抗+紫杉醇、图卡替尼等5个队列;第二部分为剂量扩展阶段,包括T-DXd单药、以上5个联用组以及T-DXd单药或联合图卡替尼用于活动性脑转移患者等8个组(0-7组)。此外,第一三共还在HER2低表达晚期乳腺癌患者中开展了类似设计的DESTINY-Breast08研究。
一项名为DEBBRAH/DS8201-A-U105的临床Ib期研究探索了T-DXd联合纳武利尤单抗治疗HER2阳性尿路上皮癌的疗效和安全性。截至2021年7月22日,共招募34例接受过铂类化疗后进展的HER2阳性尿路上皮癌患者,其中30例高表达HER2(IHC 2+/3+)的患者ORR为36.7%,其中CR 13.3%,PR 23.3%。中位DoR为13.1个月,中位PFS为6.9个月,中位OS为11.0个月。73.5%的患者发生了3级及以上TEAE,32.4%的患者中发生导致停药的TEAE。
3、维迪西妥单抗+特瑞普利单抗:探索HER2+实体瘤早线疗法
2023年3月27日,维迪西妥单抗获批两项联合疗法临床试验,分别针对乳腺癌和胃癌治疗。其中针对乳腺癌的研究,为一项评价维迪西妥单抗单药或与特瑞普利单抗联合或序贯化疗新辅助治疗HR阴性、HER2低表达乳腺癌患者有效性和安全性的随机、开放、多中心II期临床试验。另一项针对胃癌的研究,是评价维迪西妥单抗联合特瑞普利单抗及化疗或维迪西妥单抗联合特瑞普利单抗及赫赛汀一线治疗HER2表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)受试者的有效性、安全性的随机、开放、多中心的II/III期临床试验。
一项临床Ib/II期临床研究评估了RC48联合特瑞普利单抗治疗尿路上皮癌患者的安全性和疗效。自2020年8月20日至2022年1月17日,共入组了41名la/mUC患者。61%的患者未经全身性治疗,59%的患者HER2表达阳性(IHC2+或3+),32%的患者PD-L1表达阳性(CPS≥10)。研究中未观察到剂量限制毒性,推荐剂量为RC48 2mg/kg+特瑞普利单抗 3mg/kg,每2周一次。中位随访时间为8.0个月时,36名患者至少进行了一次肿瘤评估,ORR为83.3%,确认的ORR为76.7%,其中CR率为10%,在既往未经治疗的mUC患者的cORR为82.4%。DCR为96.7%,中位PFS为9.2个月且尚未成熟,未达到中位OS。最常见的TRAE为ALT/AST升高(65.9%)、外周感觉神经病变(58.5%)、食欲下降(56.1%)、乏力(56.1%)等。
(四)PD-1+TF ADC:一线及后线宫颈癌中均展现积极疗效
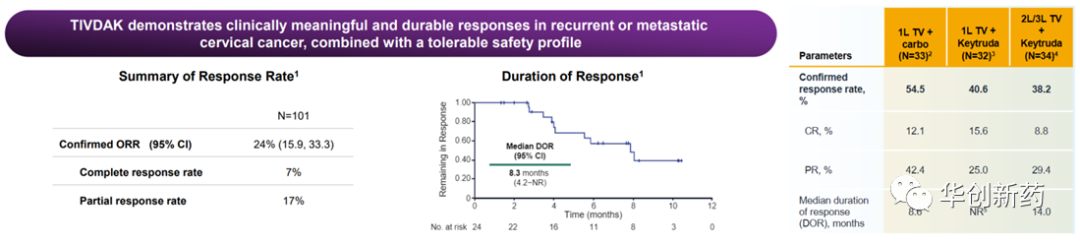
Tivdak是由Seagen开发的first-in-class靶向组织因子(tissue factor,TF)的ADC,已获批单药用于治疗在化疗期间或化疗后病情进展的复发性或转移性宫颈癌患者(ORR为24%,DOR为8.3个月)。TF在一种包括宫颈癌在内的多种实体瘤上表达的细胞表面蛋白,与肿瘤生长、血管生成、转移和不良预后相关。
ENGOT-cx8/GOG-3024/innovaTV 205研究评估了Tivdak(tisotumab vedotin,TV)联合K药用于1L或2L/3L宫颈癌患者的安全性和疗效。
33例复发或转移性宫颈癌患者接受了TV+K药作为一线治疗,中位随访时间为18.8个月时,32例可评估患者的ORR为40.6%,其中CR率15.6%,PR率25%。接受TV+K药作为二三线治疗的宫颈癌患者中,中位随访时间为15.0个月时,34例可评估患者ORR为38.2%。
(五)PD-1+LIV-1 ADC:Ladiratuzumab vedotin联合K药一线治疗TNBC
Ladiratuzumab vedotin是Seagen研发的LIV-1 ADC药物,已授权默沙东,正在和开展LV联合K药治疗TNBC及多种其他实体瘤的临床II期研究。
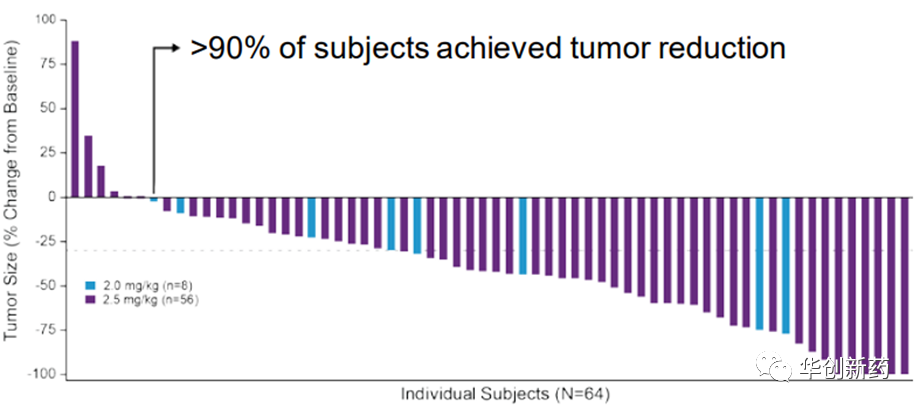
一项临床Ib/II期临床研究评估了LV联合K药用于TNBC患者一线治疗的安全性和疗效。截至2019年5月23日,共有51例患者接受了LV+K药治疗(LV 2.0和2.5 mg/kg剂量组分别为7例和44例)。在可评估安全性的51名患者中,44名(86%)报告了TEAE。在2个剂量水平中,最常见的TEAE是恶心(53%);疲劳(45%);腹泻(43%);脱发(33%);便秘和低钾血症(各占29%);呕吐(27%);食欲下降(25%);腹痛(24%);体重下降(22%);以及中性粒细胞减少症和周围感觉神经病变(各占20%)。在2个剂量水平中,最常见的3+级AE是中性粒细胞减少症(16%);腹泻、疲劳、低钾血症和黄斑丘疹(各8%);腹痛、ALT升高和尿路感染(各6%)。最常见的严重不良反应是腹痛和便秘(各占6%)。
26名患者接受了至少3个月的随访,进行了2次基线后疾病评估,确认的ORR为54%(95%CI,33.4,73.4)。另外两名患者的单次扫描显示PR,正在等待确认评估。
(六)PD-1+CEACAM5 ADC:Tusamitamab
ravtansine肺癌初步数据积极
Tusamitamab ravtansine(TUSA)是首个靶向CEACAM5的ADC,25%的非鳞状NSCLC患者CEACAM5高表达。在之前的I/II期试验中,CEACAM5表达≥50%的非鳞状NSCLC患者队列(n=64)中ORR为20.3%。
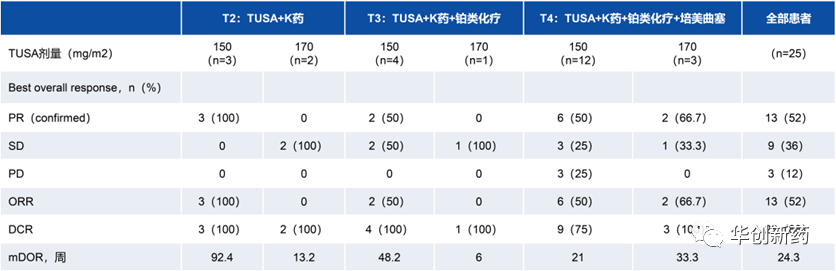
开放标签CARMEN-LC05试验纳入了非驱动基因突变的晚期/转移性非鳞状NSCLC成人患者,不限PD-L1表达水平。三个队列患者均接受每3周1次150 mg/m2或170 mg/m2的剂量TUSA,以及每3周1次的帕博利珠单抗静脉给药。队列T3的患者还接受了顺铂或卡铂治疗,而队列T4的患者接受了培美曲塞联合顺铂或卡铂治疗。
全部患者(n=25)ORR为52%(95%
CI: 31.3%-72.2%),均为经证实的部分缓解(n=13)。DCR为88%(95%
CI: 68.8%-97.5%)。
(七)多个ADC单药数据积极,已启动联合PD-1临床试验
1、EGFR/HER-3 ADC+ PD-1/CTLA-4:单药多项适应症数据优异,combo启动临床
百利天恒的EGFR/HER3双抗ADC产品BL-B01D1已经在EGFR-TKI耐药的末线肺癌患者和鼻咽癌中取得了优异的单药疗效。2023年3月21日,百利天恒公告SI-B003(PD-1/CTLA-4双抗)联合BL-B01D1(EGFR/HER3 ADC)治疗实体瘤的临床II期试验BL-B01D1-SI-B003-201获批。
2、B7H3 ADC+PD-1:单药多项适应症数据优异,combo启动临床
DS-7300是第一三共开发的B7-H3 ADC,在多个适应症中表现出优异疗效。在I/II期研究中,118例接受 DS-7300(剂量范围4.8~ 16.0 mg/kg)治疗的小细胞肺癌(SCLC)、鳞状非小细胞肺癌(NSCLC)、去势抵抗性前列腺癌(CRPC)和食管鳞癌(ESCC)患者的整体肿瘤缓解率为32%(38/118),经确认的ORR为28%(33/118)。SCLC亚组(n=19)中观察到11例肿瘤患者缓解,ORR为58%,其中经确认的ORR为53%,中位DOR为5.5个月。前列腺癌亚组(n=54)中观察到18例缓解,ORR为33%,前列腺癌亚组的中位DOR为4.4个月,CRPC亚组中40%的患者达到PR,包括46%存在基线肝脏转移的患者。
MacroGenics的同类ADC产品MGC018已经启动了联合PD-1单抗以及PD-1/CTLA-4双抗的临床I/II期试验。
3、CLDN18.2 ADC+PD-1启动临床:胃癌数据优异,combo启动临床
康诺亚和乐普生物合作的CLDN18.2 ADC产品CMG901的Ia期研究表现出针对胃癌的优异疗效。截至2022年8月4日,CMG901 Ia期临床研究共入组27例患者(13例患有胃癌/胃食管结合部腺癌,14例患有胰腺癌)。研究结果显示,8例接受CMG901治疗的CLDN18.2阳性胃癌患者中,ORR为75%,DCR为100%。其中,2.6、3.0和3.4mg/kg队列患者的ORR均为100%。mPFS和mOS均尚未达到。
2023年3月27日,康方生物宣布与礼新医药共同推进PD-1/VEGF双抗依沃西(AK112)联合CLDN18.2 ADC(LM-302)针对相关实体肿瘤的一系列临床研究。
2021年10月,礼新医药宣布与国内领先的生物制药企业君实生物签署了一项联合用药框架合作协议。根据该协议,礼新医药系列临床阶段创新药品将与君实生物在联合用药领域开展互惠的多项中外临床试验合作。
三、IO+ADC正在开启肿瘤免疫新时代
从现有数据来看,IO+ADC正在进一步提升一批适应症PD-1+化疗的疗效水平。例如:
多个IO+ADC联合疗法在于尿路上皮癌患者的一/二线治疗中展现出更优的ORR和PFS水平。
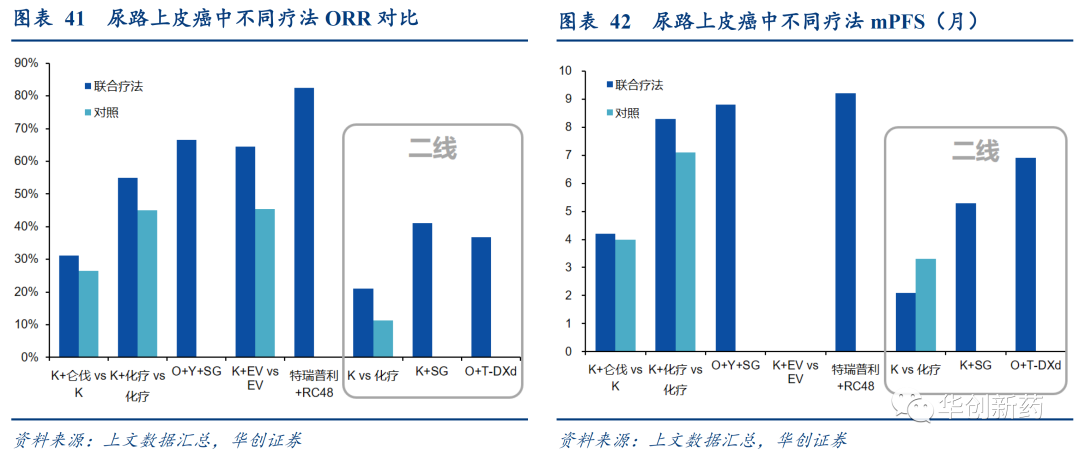
TROP2 ADC联合疗法在TNBC中表现出更好的ORR和PFS,有望成为一线治疗新选择。
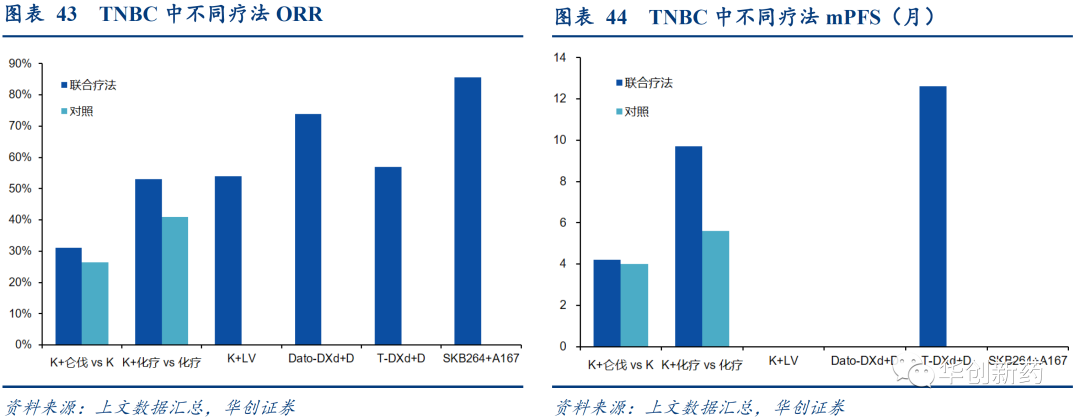
我们认为:
1) 从现有临床数据来看,IO+ADC有望成为未来十年肿瘤免疫的新主线。
回顾PD-1疗法的研发历程,在经历多种联合疗法探索后,PD-1联合化疗疗法在一线适应症取得积极疗效。ADC药物作为一种“高效、靶向化疗”,有望与PD-1联合发挥协同效果,成为下一代肿瘤治疗的探索方向。
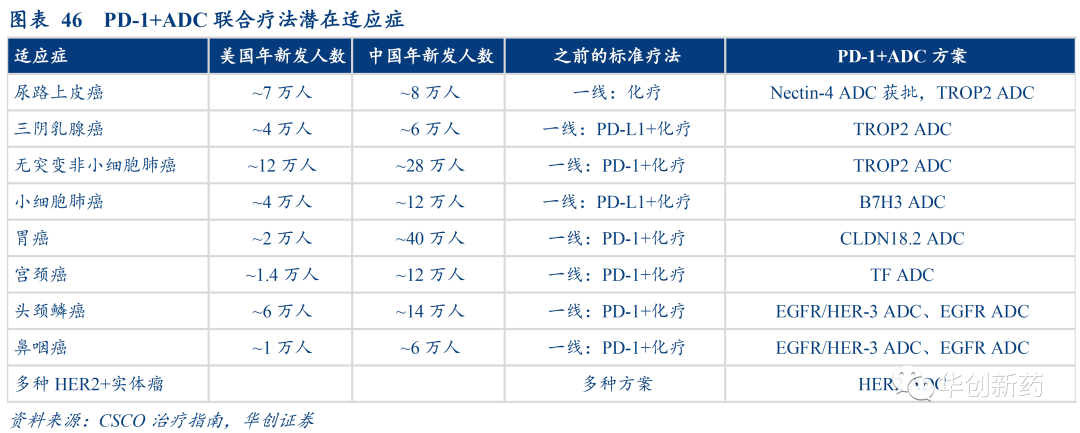
2) 现有的IO疗法中,近一半方案可能从IO+化疗升级为IO+ADC,相关适应症市场有望实现100-200%扩容。
包括尿路上皮癌(获批)、三阴乳腺癌、非小细胞肺癌、小细胞肺癌、胃癌、宫颈癌等一系列适应症的一线疗法均有潜力从PD-1+化疗升级迭代为PD-1+ADC。
3) 随着中国ADC进入世界第一梯队,未来中国公司有望在IO+ADC浪潮中占据重要地位,实现国际化价值。

重点关注IO+ADC领先标的。
风险提示:临床研究失败的风险;临床推进速度不达预期的风险。
华创证券研究所定位为面向专业投资者的研究团队,本资料仅适用于经认可的专业投资者,仅供在新媒体背景下研究观点的及时交流。华创证券不因任何订阅本资料的行为而将订阅人视为公司的客户。普通投资者若使用本资料,有可能因缺乏解读服务而对报告中的关键假设、评级、目标价等内容产生理解上的歧义,进而造成投资损失。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)