2023-12-06

星形胶质细胞是中枢神经系统(CNS)中最丰富的胶质细胞,在CNS中它们执行着广泛的内稳态功能,例如通过缓冲过量的神经递质和调节突触、血脑屏障(BBB)功能,为其他中枢神经系统常驻细胞提供支持。在神经系统疾病的背景下,许多这些内稳态功能都会受损。此外,星形胶质细胞激活状态对多发性硬化症(MS)、阿尔茨海默病(AD)、帕金森病(PD)、亨廷顿病(HD)和其他疾病的病理形成有一定影响。细胞与细胞的相互作用是星形胶质细胞稳态功能和疾病相关反应的中心调节因子。因此,全面了解星形胶质细胞与中枢神经系统常驻细胞和中枢神经系统招募细胞的通讯,对于确定疾病发病机制和制定神经系统疾病的干预治疗措施至关重要。
哈佛医学院布莱根妇女医院Francisco J. Quintana研究团队继去年5月发表一篇关于星形胶质细胞的综述文章Function and therapeutic value of astrocytes in neurological diseases后,11月初又发表了一篇关于星形胶质细胞的综述文章Neuroinflammation: An astrocyte perspective,在这篇综述中,研究团队侧重阐述了星形胶质细胞与其他中枢神经系统常驻细胞和中枢神经系统浸润细胞之间复杂的相互作用,以及它们在炎症和神经退行性病变方面的潜在治疗价值。

正文
01神经炎症中的反应性星形胶质细胞
星形胶质细胞通过“反应性星形胶质细胞产生(reactive
astrogliosis)”的过程重塑其形态、基因组、代谢和功能特征,从而对急性或慢性病理刺激做出反应。尽管在各种刺激中反应性星形胶质细胞产生的某些方面是相同的,但星形胶质细胞诱导的反应会因特定刺激或疾病、时间和所涉及的中枢神经系统位置而异,导致星形胶质细胞表型在疾病中具有不同的作用,有时甚至是相反的作用。
单细胞RNA测序(scRNA-seq)、空间转录组学和细胞间相互作用鉴定平台等技术发展为研究健康和疾病中的星形胶质细胞异质性开辟了新的途径,基于细胞形态、分子谱、细胞功能和细胞与细胞相互作用来鉴定星形胶质细胞不同集群或不同激活状态。由于这些研究的横断面性质,目前尚不清楚多数这些星形胶质细胞亚群中是根据发育界定的星形胶质细胞群(发育诱导的星形胶质细胞,developmentally induced astrocytes),还是由不同刺激诱导的多种激活状态(刺激诱导的星形胶质细胞,stimulus-induced astrocytes)。这些不确定性只能通过在发育过程中、在体内平衡和病理相关刺激的背景下进行的全面谱系追踪研究来解决。同时,在解释有关星形胶质细胞异质性的报告时,应牢记这些局限性。
在稳态过程中,星形胶质细胞亚型表现出与它们的所在位置、以及与CNS中其他细胞的相互作用有关的基因组和功能特征。然而,在CNS炎症和神经退行性变化的情况下,星形胶质细胞的细胞状态与特定疾病刺激的特定基因组模块的激活或抑制相关。例如,scRNA-seq结合蛋白质组学技术鉴定了星形胶质细胞在稳态条件下表达肿瘤坏死因子相关凋亡诱导配体(TRAIL)以响应自然杀伤(NK)细胞产生的干扰素-γ (IFN-γ);这些星形胶质细胞在CNS边界通过诱导T细胞凋亡来限制炎症。相比之下,scRNA-seq研究发现了一种由MAF碱性亮氨酸拉链转录因子G (MAFG)/甲硫氨酸腺苷转移酶2α (MAT2α)控制、由促炎T细胞产生的粒细胞-巨噬细胞集落刺激因子(GM-CSF)驱动的致病星形胶质细胞状态,这种状态可促进多发性硬化症(MS)和小鼠实验性自身免疫性脑脊髓炎(EAE)模型中的CNS病理。在PD中,基于波形蛋白(vimentin)和LIM homobox 2的表达、以及CD44和未折叠蛋白反应相关基因的上调,已经确定了与神经退行性变相关的星形胶质细胞状态。类似地,Hasel 等人发现了在脂多糖(LPS)给药后的两种星形胶质细胞反应状态。其中一种星形胶质细胞状态的特征是金属蛋白酶抑制剂Timp1的富集,表明了其具有神经保护和抗氧化功能。另一种星形胶质细胞状态的特征是与干扰素信号、血管生成和抗原呈递相关的基因表达。总之,这些发现说明了星形胶质细胞在CNS稳态和病理背景下的异质性。
重要的是,超过97%的星形胶质细胞终足至少接触一根血管,使星形胶质细胞膜通道、转运体和受体不仅能感知CNS的内在信号,还能感知循环中的分子并作出反应。在这种情况下,细胞因子、代谢物和其他细胞产物,以及环境因素(如环境化学物质和微生物代谢物),共同调节星形胶质细胞与抗原呈递、共刺激和凋亡相关的反应(表1)。例如,共生菌群提供调节星形胶质细胞中芳香烃受体(AHR)活性的小分子,这限制了NF-κB驱动的促炎细胞因子和趋化因子的表达,从而限制了CNS炎症。相反,除草剂linuron通过sigma受体1 (SigmaR1) -肌醇需求酶1α (IRE1α)依赖机制,促进星形胶质细胞中转录因子NF-κB和x-box结合蛋白1
(XBP1)的激活。这种环境化学驱动的通路促进参与MS和EAE的发病机制的促炎基因(IL6、CCL2、CSF2和NOS2)的表达,而会通过盐质激素受体核受体亚家族3c组成员2(NR3C2)及其共抑制因子核受体共抑制因子2(NCOR2)的信号传导被抑制。
表1:CNS炎症中星形胶质细胞的调节因子
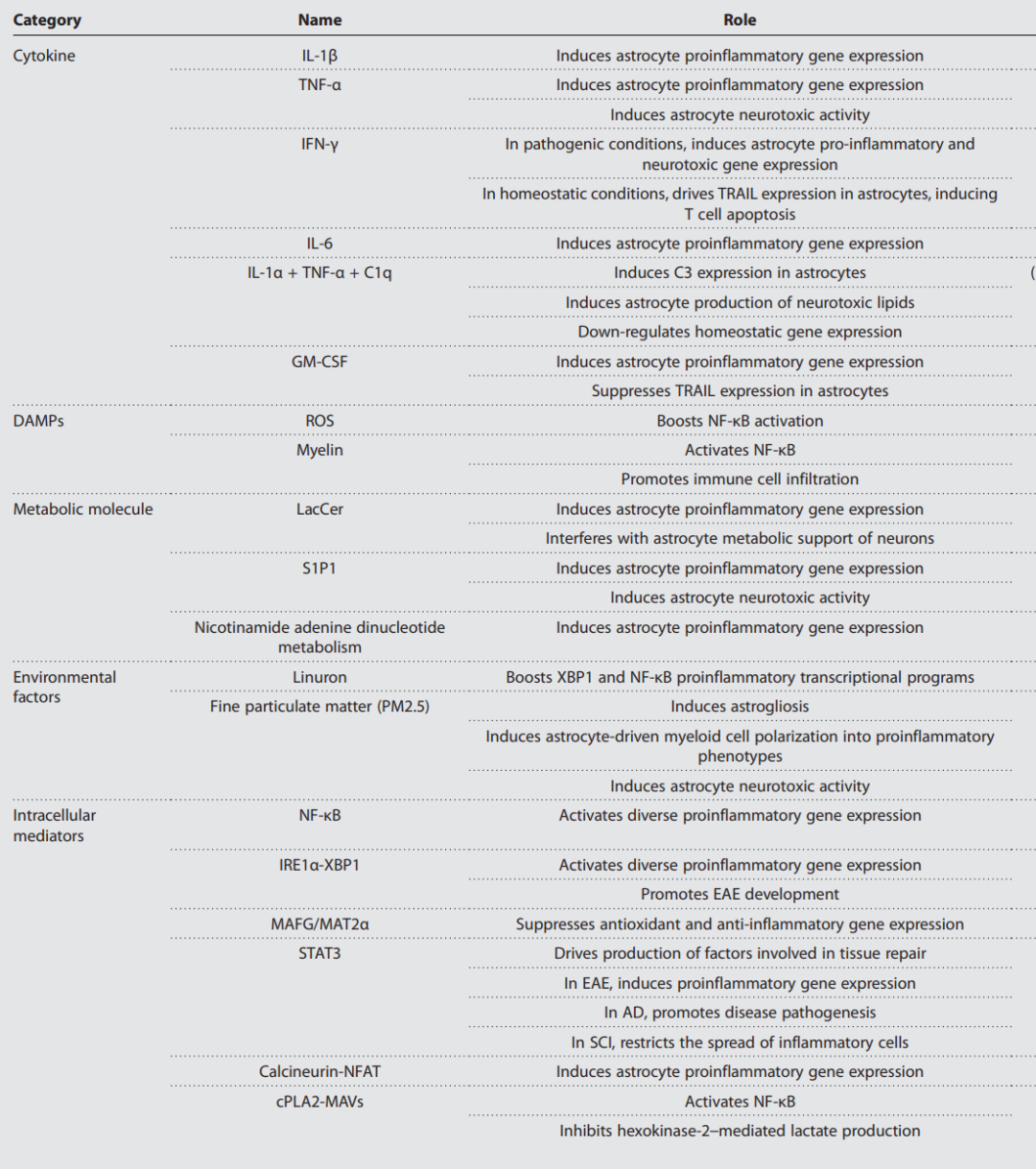
星形胶质细胞的反应性和与之相关的特定信号通路在各种CNS疾病中也有差异调节。例如,多项研究强调了反应性星形胶质细胞中STAT3信号通路的重要性。星形胶质细胞选择性的STAT3失活可减少β-淀粉样蛋白(Aβ)斑块,并改善APP/PS1
AD小鼠模型的空间学习和记忆。此外,在CNS炎症中,IL-6通过STAT3信号传导调节与神经毒性相关的星形胶质细胞。然而,在创伤性损伤的情况下,反应性星形胶质细胞在CNS病变周围形成边界,从而限制炎症。星形胶质细胞特异性的STAT3失活会损害运动恢复,并显著增加脊髓损伤(SCI)中的促炎基因转录,表明了STAT3控制的星形胶质细胞产物在CNS修复中的作用。因此,星形胶质细胞中的 STAT3以情境特异性(context-specific)的方式控制CNS炎症和神经变性。
这些发现表明了确定能决定星形胶质细胞反应的功能结果的STAT3和其他信号通路之间复杂的相互作用非常重要。最重要的是,这些研究强调了中枢神经系统病理中星形胶质细胞反应的异质性,包括星形胶质细胞与CNS常驻细胞、及被募集到CNS的周围细胞相互作用影响的疾病促进、疾病抑制或治愈反应。因此,揭示星形胶质细胞的不同反应、亚型和状态的调节机制,以及它们与中枢神经系统常驻细胞和中枢神经系统浸润细胞的相互作用,对于开发有效的神经系统疾病治疗具有至关重要的意义。
02神经炎症中星形胶质细胞与中枢系统常驻细胞的相互作用
图1:星形胶质细胞与中枢神经系统常驻细胞的交叉对话

星形胶质细胞与神经元的相互作用
星形胶质细胞与神经元相互作用已被广泛研究(图1)。星形胶质细胞在神经元发育和突触成熟中发挥重要作用。此外,星形胶质细胞调节着突触传递和神经回路功能。例如,星形胶质细胞参与形成“三重组分突触”,这是由星形胶质细胞和神经元突触形成的功能单位,可以实现星形胶质细胞与神经元的有效交叉对话。星形胶质细胞通过分泌突触生成因子、吞噬结构突触和缓冲突触谷氨酸来支持突触功能。在神经系统疾病的背景下,这些功能和其他参与支持突触的星形胶质细胞稳态功能受损。例如,由小胶质细胞TNF(肿瘤坏死因子)、IL-1α 和补体成分1q (C1q)诱导的补体C3+星形胶质细胞失去突触发生因子和吞噬受体的表达,导致星形胶质细胞驱动的突触形成和突触修剪的缺陷,扰乱神经回路的重新布线和完整性。此外,在多发性硬化症和帕金森病中,反应性星形胶质细胞丧失谷氨酸再摄取转运体谷氨酸转运体1(GLT-1)和谷氨酸天冬氨酸转运体1 (GLAST-1)的表达,导致细胞外突触谷氨酸浓度增加,从而导致兴奋性毒性驱动的神经元死亡。
还有其他机制介导星形胶质细胞与神经元的通讯。例如,星形胶质细胞将葡萄糖代谢成乳酸,供应给神经元以支持其代谢。这种“乳酸穿梭”是由单羧酸转运体介导的,其表达并不局限于三重组分突触。星形胶质细胞和神经元之间的代谢交叉对话在炎症期间受到干扰,从而增强神经毒性。促炎细胞因子诱导的星形胶质细胞代谢重塑促进乳糖神经酰胺 (LacCer)的产生,其可以激活胞质磷脂酶A2 (cPLA2)。cPLA2激活触发其与线粒体抗病毒信号传导(MAVS)蛋白CARD结构域的物理性相互作用,导致NF-κb驱动的促炎反应的激活。这种 cPLA2-MAVS相互作用也取代了己糖激酶2与MAVS的相互作用,限制了乳酸的产生并进一步给神经元造成压力。在HD、AD和PD中也观察到类似的结果,强调了星形细胞与神经元代谢的分离在中枢神经系统炎症中的重要性。
在成熟的大脑中,每个星形胶质细胞与特定区域内的神经元和突触相互作用并维持,该特定区域不与邻近星形胶质细胞所接触区域重叠。Endo和其同事最近报道了临床前AD模型中星形胶质细胞区域的萎缩。此外,他们还发现Fermt2和Ezr是星形胶质细胞区域的调节因子。有趣的是,在包括多发性硬化症和帕金森病在内的几种神经系统疾病中发现了这些区域相关基因的表达减少,这表明稳态星形胶质细胞功能受损与中枢神经系统病理之间存在额外的机制联系。然而,参与这些稳态星形胶质细胞功能失调的机制仍未完全了解。
星形胶质细胞驱动的神经毒性的证据越来越多。星形胶质细胞中NF-κB的激活促进了神经毒性一氧化氮(NO)的产生。Sajio等人报道,PD危险因子核受体相关因子1蛋白下调可导致神经毒性NO和活性氧的产生。此外,Bi等人报道,在TDP43蛋白病变模型中,反应性星形胶质细胞分泌对神经元也有毒性的脂质运载蛋白-2(lip-ocalin2, LCN2)。此外,小胶质细胞诱导的反应性星形胶质细胞存在于HD、AD、PD和MS脑样本中,通过分泌神经毒性脂肪酸促进神经元死亡,这表明不同神经系统疾病中相同的星形胶质细胞病理驱动机制。有研究称胰高血糖素样肽1(GLP-1)受体激动剂可阻断小胶质细胞诱导这些神经毒性星形胶质细胞。然而,与特定转录反应和细胞反应相关的星形胶质细胞激活存在疾病特异性的触发因素,表明多种具有神经毒性活性的星形胶质细胞状态可以被诱导。这进一步表明,即使在同一疾病的背景下,星形胶质细胞驱动的神经毒性也可能存在多种机制。
相反,也发现了反应性星形胶质细胞驱动的神经保护机制。L’Episcopo等人认为,反应性星形胶质细胞是无翅型MMTV整合位点1 (Wnt1)的来源之一,而Wnt1深度参与多巴胺能(DAergic)神经元的发育和恢复。研究者发现星形胶质细胞表达Wnt1以应对MPTP(1-methly-4-phenyl1–1,2,3,6-tetrahydropyridine)驱动的DAergic 神经元退行性变化。星形胶质细胞产生的Wnt1与多巴胺能神经元中的frizzed受体和β-catenin结合,促进其存活、修复和神经发生。Anderson及其同事进一步支持了神经保护性星形胶质细胞机制的生理学相关性,他们在脊髓损伤背景下界定了反应性星形胶质细胞在轴突再生中的核心作用,表明了反应性星形胶质细胞表达支持轴突生长的cspg4和cspg5。
总的来说,这些发现突出了星形胶质细胞与神经元相互作用在神经系统疾病病理中发挥的多重角色,有时甚至是相反的。在多种神经系统疾病中生成星形胶质细胞单细胞数据集及其临床前模型将能识别出星形胶质细胞中的共同的和疾病特异性的机制。此外,在研究星形胶质细胞驱动的神经元损伤机制时,区分神经毒性的主动诱导和星形胶质细胞支持神经元健康和存活的功能的损害是很重要的,这两者在体外都可能导致神经元死亡。
星形胶质细胞与少突胶质细胞的相互作用
少突胶质细胞传统上被认为是MS中炎症反应的靶点,但最近的证据也表明,少突胶质细胞在CNS炎症中发挥积极作用(图1)。少突胶质细胞表达多种细胞因子、免疫调节因子及其受体。例如,Kim及其同事报道,星形胶质细胞促进小胶质细胞TNF-α释放,其结合在少突胶质前体细胞(oligodendrocyte precursor cells,OPCs)中表达的TNF受体1,并以接触依赖的方式诱导细胞毒性。
相反,星形胶质细胞也被证明在髓鞘再生中发挥多重作用。OPCs被招募到CNS损伤处,以响应星形胶质细胞产生的IL-1β和C-C基序趋化因子配体2 (CCL2)。一旦被招募到病变处, OPCs在睫状神经营养因子(CNTF)的作用下分化为成熟的少突胶质细胞。有趣的是,星形胶质细胞中Nrf2通路的下调可促进少突胶质细胞的存活和髓鞘再生。木犀草素Luteolin抑制Nrf2信号传导,促进髓鞘再生,表明星形胶质细胞与少突胶质细胞相互作用可能为治疗脱髓鞘疾病提供新的靶点。
此外,少突胶质细胞产生促炎细胞因子(如IL-1β、CCL2、 IL-17和IL-6),促进星形胶质细胞的促炎性反应。此外,最近有报道称,在MS发病过程中,少突胶质细胞通过下调紧密连接蛋白破坏血脑屏障(BBB)。这种BBB破坏是由少突胶质细胞与星形胶质细胞终足竞争性包盖血管所驱动。鉴于与年龄相关的髓鞘再生受损,确定星形胶质细胞与少突胶质细胞的相互作用是否在衰老过程中受到干扰是很重要的,这是开发促进髓鞘再生的治疗策略的一个重要点,特别是在髓鞘再生缺陷和疾病进展与衰老相关的神经系统疾病中,如MS。
星形胶质细胞与小胶质细胞的相互作用
星形胶质细胞分泌的IL-33促进了小胶质细胞依赖性的发育突触修剪,突出了星形胶质细胞与小胶质细胞交叉对话在神经回路发育中的重要性(图1)。此外,小胶质细胞因子在CNS炎症中调节星形胶质细胞的致病活动。例如,Bezzi等人发现,小胶质细胞TNF-α诱导SDF-1— CXCR4信号传导驱动星形胶质细胞释放谷氨酸,促进神经元死亡。类似地,小胶质细胞TNF-α、IL-1α和C1q被证明可以诱导星形胶质细胞的神经毒性表型。此外,小胶质细胞血管内皮生长因子B (VEGF-B)和转化生长因子α (TGF-α)在EAE和MS中对星形胶质细胞促炎基因表达的调节存在差异。小胶质细胞VEGF-B促进VEGF受体1
(FLT-1)驱动的NF-κB活化,增强EAE星形胶质细胞的致病活性。相反,小胶质细胞TGF-α 通过激活表皮生长因子受体ErbB1信号传导来限制EAE的进展。有趣的是,小胶质细胞中VEGF-B或TGF-α的产生是由饮食色氨酸的微生物代谢产物调控的,这些代谢产物穿过BBB,调节小胶质细胞和星形胶质细胞中的AHR信号,这为脑肠轴控制中枢神经系统常驻细胞及其相互作用提供了新的见解。
星形胶质细胞也可以调节CNS病理背景下的小胶质细胞反应。B4GALT6驱动的LacCer产生诱导星形胶质细胞分泌GM-CSF,调节小胶质细胞和中枢神经系统浸润单核细胞的转录反应。类似地,星形胶质细胞中的SigmaR1-IRE1α-XBP1轴不仅驱动星形胶质细胞促进CNS病理的内在反应,还通过尚未表征的星形胶质细胞与小胶质细胞通讯机制驱动小胶质细胞病理反应。Kiss与其同事最近报道,尽管由IL-3驱动的星形胶质细胞对小胶质细胞的控制可能限制AD的病理进展,星形胶质细胞产生的IL-3在小胶质细胞和单核细胞中诱导促进疾病的反应,引发MS的病理。相反,Jo等人报道,在LPS诱导的系统性CNS炎症中,星形胶质细胞可以通过产生类粘蛋白2 (Orm2)抑制小胶质细胞的激活。这些发现突出了星形胶质细胞与小胶质细胞相互作用的复杂性,并确定了IL-3、GM-CSF和Orm2在星形胶质细胞控制小胶质细胞中的重要作用。
星形胶质细胞与小胶质细胞的相互作用是多样而复杂的,具有促炎和抗炎的结果和反馈机制。为了解读星形胶质细胞小胶质细胞相互作用的复杂性,该研究团队设计了一个基于小胶质细胞与星形胶质细胞液滴共培养的正向遗传筛选平台,其中小胶质细胞中的基因已被系统地失活,以确定这种扰动对星形胶质细胞的影响;研究团队将该平台命名为SPEAC-seq。在其第一代平台中,研究团队共封装了在NF-κB激活后表达绿色荧光蛋白的转基因原代星形胶质细胞,和用全基因组CRISPR-Cas9文库转导的小胶质细胞。该方法确定了一个调节通路,
即星形胶质细胞在炎症背景下释放的IL-33触发小胶质细胞产生双调节蛋白(AREG),AREG作用于星形胶质细胞以限制其促炎反应。
小胶质细胞与星形胶质细胞的相互作用也可能涉及通过膜结合分子的接触。在EAE模型中使用RABID-seq平台,研究团队确定了plexin B2 /1 - Sema4D和ephrin B型受体3 (EphB3) -EphrinB3信号作为星形胶质细胞与小胶质细胞相互作用的潜在介质;这些相互作用后来在人体系统中得到了验证。最重要的是,这些相互作用的失活抑制了小胶质细胞和星形胶质细胞的促炎反应,突出了星形胶质细胞-小胶质细胞相互作用途径作为神经系统疾病治疗靶点的潜在价值。
图2:星形胶质细胞在CNS边界的交叉对话
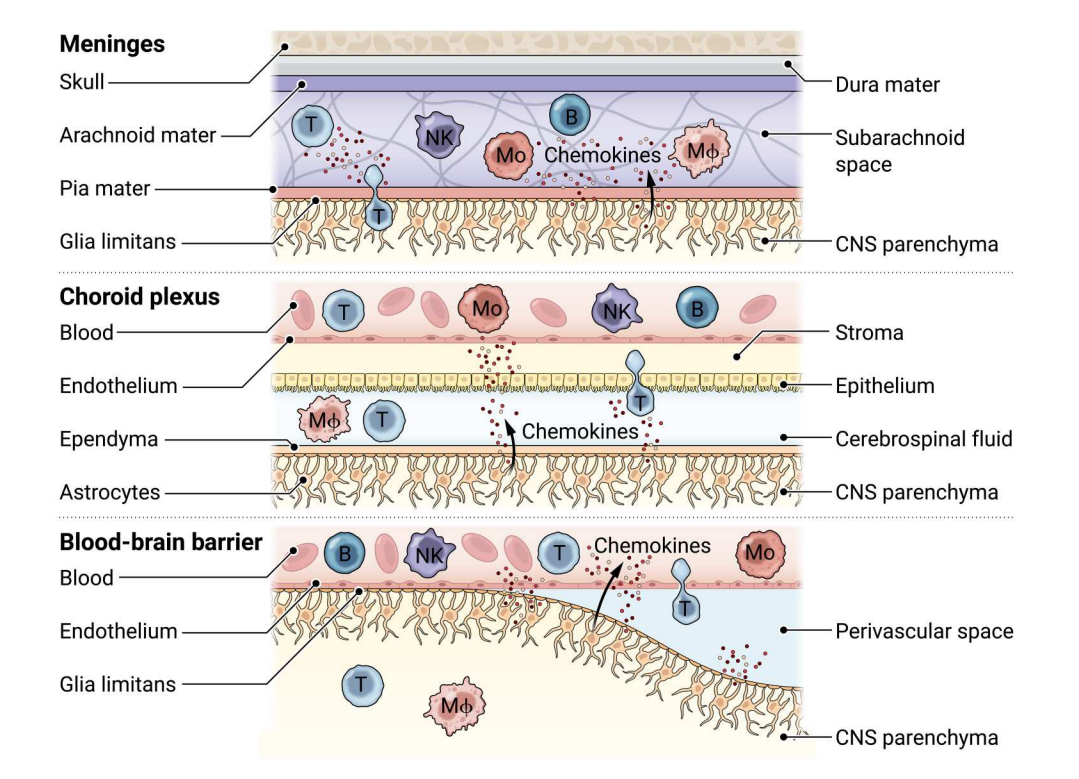
星形胶质细胞与T细胞的相互作用
星形胶质细胞是BBB的主要组成部分,形成胶质界膜,这是包围外周细胞、内皮细胞和基底层的屏障,限制白细胞进入CNS(图2)。然而,BBB破坏和功能障碍可促进白细胞侵入CNS实质。在这种情况下,星形胶质细胞是浸润的T细胞首先遇到的常驻细胞之一,不仅调节T细胞的迁移,还调节T细胞的激活(图3)。例如,MS病变中的星形胶质细胞表达IL-27,这限制了TH17的促炎细胞反应,同时促进抗炎1型调节性(Tr1)细胞和FoxP3+调节性T(Treg)细胞的分化。星形胶质细胞IL-27的产生已被证明可以限制髓磷脂特异性T细胞中的细胞增殖和细胞因子 (IFN-γ、IL-17、TGF-β和IL-4)的产生。星形胶质细胞还诱导 CD4+T细胞中的细胞毒性T淋巴细胞相关蛋白4(CTLA-4)、CD39和CD73的表达,进一步限制了它们的激活。最后,星形胶质细胞通过FasL和TRAIL的表达诱导T细胞凋亡。
相反,作为对缺血性卒中的反应,星形胶质细胞表达IL-15,它招募CD8 T细胞并增强其在脑损伤中的效应功能。此外,星形胶质细胞在活跃的MS病变中表达MHC II类和共刺激分子(如CD80和CD86),但这些发现的生理学重要性尚未完全了解。在体外小鼠原代星形胶质细胞中,IFN-γ上调MHC II类和共刺激分子的表达,但在人胎儿星形胶质细胞的研究中未能检测到IFN-γ诱导的CD80 (B7-1)和CD86 (B7-2)的表达。考虑到IFN-γ信号在CNS炎症背景下星形胶质细胞中的保护作用,应进一步的研究IFN-γ对MHC、细胞因子、检查点和其他与调节T细胞反应相关的分子的表达的影响。
星形胶质细胞是趋化因子的重要来源,如CCL1、CCL2、CCL20和CXCL10。NF-κb驱动的星形胶质细胞中的CCL2和CXCL10表达将促炎T细胞和单核细胞招募到CNS,促进MS和EAE病理。此外,通过TH17细胞表达的RANK(NF-κB受体激活因子)配体激活星形胶质细胞中的RANK可触发CCL20的产生,从而促进CNS炎症期间效应T细胞的再募集。同样,TGF-β激活激酶1(TAK1)驱动的CXCL1产生促进CXCR2 +CD4 T细胞向脊髓灰质迁移,从而导致神经元损伤和运动功能障碍。星形胶质细胞产生的趋化因子(CCL1和CCL20)也会在中风的情况下招募Treg细胞。
重要的是,星形胶质细胞和T细胞之间的关系是双向的,T细胞也可以塑造星形胶质细胞的反应。星形胶质细胞表达IL-17和GM-CSF受体,IL-17和GM-CSF是由与MS、EAE和其他疾病病理相关的促炎TH17细胞产生的。TH17源的IL-17最初被认为上调星形胶质细胞中Act1依赖性促炎细胞因子(GM-CSF)和趋化因子(CXCL1、CXCL2和CCL20)的产生,促进EAE中白细胞向CNS的再募集。然而,后来发现IL17的这些作用主要与表达神经/胶质抗原2的胶质细胞有关。因此,对IL-17信号在星形胶质细胞反应控制中的作用的理解仍然有限。然而,GM-CSF被发现促进MS和EAE中MAFG/ MAT2α依赖的促炎性星形胶质细胞状态分化,同时限制星形胶质细胞中T细胞凋亡诱导剂TRAIL的表达。
此外,有研究报道星形胶质细胞与Treg细胞的相互作用可以限制CNS炎症。例如,中枢系统浸润Treg细胞通过产生AREG抑制中风期间的神经毒性星形胶质细胞增生,AREG是一种在肠道等其他组织中与组织修复有关的分子。此外,Tr1细胞通过IL-10抑制EAE中致病星形胶质细胞的活性。有趣的是,星形胶质细胞与T细胞相互作用是在基于病毒的条形码研究细胞-细胞通讯的方法中被检测到;未来可能会有研究者使用这些方法和其他方法来剖析特定星形胶质细胞和T细胞亚群之间复杂的通信机制。总之,这些发现强调了星形胶质细胞与T细胞通讯在神经炎症反应中的重要性,并表明纳米材料或工程益生菌诱导的T细胞亚群可用于星形胶质细胞反应的治疗性调节。
星形胶质细胞与单核吞噬细胞的相互作用
外周单核吞噬细胞(包括单核细胞和树突状细胞)的募集在中枢神经系统炎症中起重要作用(图3)。在MS和EAE中,星形胶质细胞源的CCL2将促炎单核细胞重新募集到中枢神经系统。星形胶质细胞中CCL2 的缺失减少了与脱髓鞘和神经元死亡有关的促炎单核细胞源性巨噬细胞的募集和极化。然而,星形胶质细胞源的CCL2也可以招募巨噬细胞促进组织修复, 这表明星形胶质细胞可以以背景特异性的方式促进促炎和修复机制。此外,这些发现强调了对星形胶质细胞调控特定外周髓细胞亚群募集的分子机制以及这些亚群的功能异质性的理解是有限的。
星形胶质细胞与NK细胞的相互作用
在中枢神经边界存在不同的免疫壁龛。在生理和病理条件下,包裹大脑和脊髓的脑膜已被确定为外周免疫亚群和中枢神经系统常驻细胞之间交流的重要部位。最近有报道称,通过脑膜循环的NK细胞通过产生IFN-γ诱导稳态星形胶质细胞中TRAIL的表达,从而使表达死亡受体5的促炎T细胞凋亡。值得注意的是,通过脑膜循环的NK细胞获得了在肠道组织中产生IFN-γ的能力,以响应共生菌群提供的信号(图3)。这些发现确定了肠道-中枢神经系统轴用于控制炎症的机制,这不仅揭示了微生物群在神经系统疾病病理中的潜在作用,而且还为治疗干预提供了令人兴奋的机会。
相反,星形胶质细胞也可调节NK细胞的活性。例如,星形胶质细胞中的IL-15过表达会加剧缺血性脑损伤,部分原因是NK细胞介导的免疫反应增加 (图3)。总的来说,这些发现强调了星形胶质细胞与NK细胞交叉对话在中枢神经系统稳态和病理背景下的重要性,对特定NK细胞亚群在这些相互作用中的作用的进一步研究将非常有意义。
图3:星形胶质细胞与外周免疫细胞的交叉对话
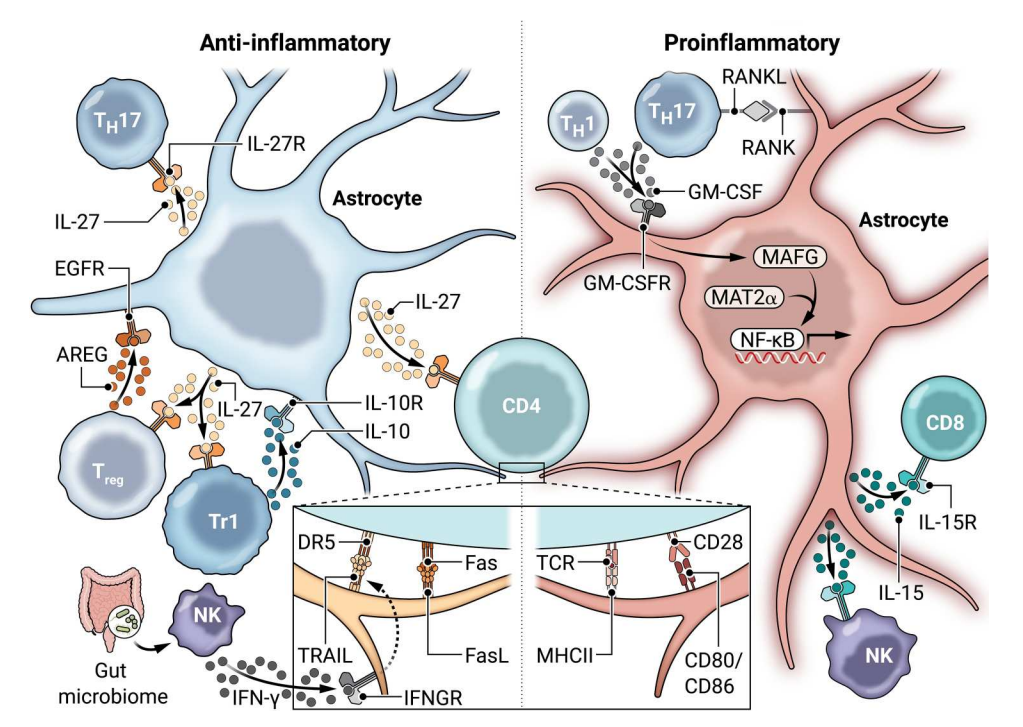
星形胶质细胞与B细胞的相互作用
B细胞在中枢神经系统稳态和病理中发挥着重要作用,这一点在MS和其他神经系统疾病中靶向B细胞治疗的成功中得到了强调。在MS斑块中,星形胶质细胞产生B细胞活化因子,该因子在B细胞的发育和存活以及抗体的产生中起着至关重要的作用。人类星形胶质细胞产生的分泌因子促进B细胞亚群的存活和激活,包括继发性进展性MS患者的记忆B细胞。在MS和卒中中,星形胶质细胞分泌CXCL12,促进浆细胞的维持和存活,这表明星形胶质细胞在CNS中控制致病性B细胞的作用。
B细胞产物也会影响星形胶质细胞的功能和存活。与水通道蛋白4反应的抗体通过诱导星形胶质细胞功能障碍和死亡来驱动视神经脊髓炎的病理。此外,最近有报道称, MS中的B细胞产生与胶质细胞粘附分子(Glial-CAM)反应的抗体,Glial-CAM是一种由胶质细胞(包括星形胶质细胞)表达的免疫球蛋白样细胞粘附分子。尽管Glial-CAM反应性抗体对星形胶质细胞的作用尚不清楚,但这些发现表明星形胶质细胞(或其死亡)在MS中的其他作用。此外,这些发现表明星形胶质细胞与B细胞相互作用在神经系统疾病中的其他作用。有趣的是,据报道,肠道来源的产生免疫球蛋白A的B细胞可以减轻中枢神经系统炎症,也可以产生IL10,一种已知可以限制MS和EAE中星形胶质细胞致病活性的细胞因子。因此,未来的研究应超越星形胶质细胞反应性抗体的致病作用,探究B细胞及其产物对星形胶质细胞功能的调节,以及其与肠道-中枢神经系统轴在健康和疾病中的相关性。
细胞间相互作用在星形胶质细胞对健康和疾病的功能控制中起着核心作用。这些相互作用在神经系统疾病中受到干扰,表明星形胶质细胞和其他目的细胞的疾病相关连接体可能成为治疗干预的重要靶点。
一个重要的挑战是为靶向连接体的治疗干预选择适当的递送模式。穿越中枢神经系统的小分子为治疗剂提供了独特的机会。例如,CNS渗透小分子A38已被证明通过抑制EphB3受体信号传导来限制CNS炎症,EphB3受体被确定为EAE和MS中星形胶质细胞与小胶质细胞相互作用的调节因子。此外,基于病毒载体的基因治疗方法可能为靶向CNS细胞间相互作用的治疗提供独特的机会。腺相关病毒(AAV)平台的最新进展引领了穿透血脑屏障的AAV衣壳的发展。类似地,治疗性抗体可以被设计来增加其CNS通透性。最后,肠脑轴在中枢常驻细胞调控中的重要作用表明,它可以被当做限制中枢常驻细胞病理反应的靶标。在这种情况下,工程益生菌提供了限制CNS病理的新工具。
然而,每一种方式都存在相关的技术挑战,如小分子的特异性、病毒载体诱导不必要的免疫反应及其长期影响,以及治疗性抗体的CNS渗透性。此外,对于开发靶向星形胶质细胞和CNS中其他细胞的连接体的有效治疗方法,仍然需要解决一些重要问题:多种神经系统疾病是否存在共同的细胞间相互作用机制的扰动?如何特异性靶向星形胶质细胞或其他细胞类型的亚型和状态,以重建其稳态功能并抑制其致病活性?可以靶向哪些细胞间相互作用来促进CNS的修复,以及这些机制如何受到衰老的影响?解决这些问题和其他相关问题将为开发有效的神经系统疾病连接体靶向治疗奠定基础。
论文链接:
DOI: 10.1126/scitranslmed.adi7828
百度浏览 来源 : 解构科学
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。




发表评论
注册或登后即可发表评论
登录注册
全部评论(0)