标记和可视化蛋白质是研究细胞生物学的基本工具,可以用于监测蛋白质动态变化和解析细胞内复杂相互作用,从而理解特定感兴趣蛋白质(protein of interest,POI)的细胞功能。荧光成像技术在活细胞中研究蛋白质定位、功能及互作方面发挥着巨大作用。
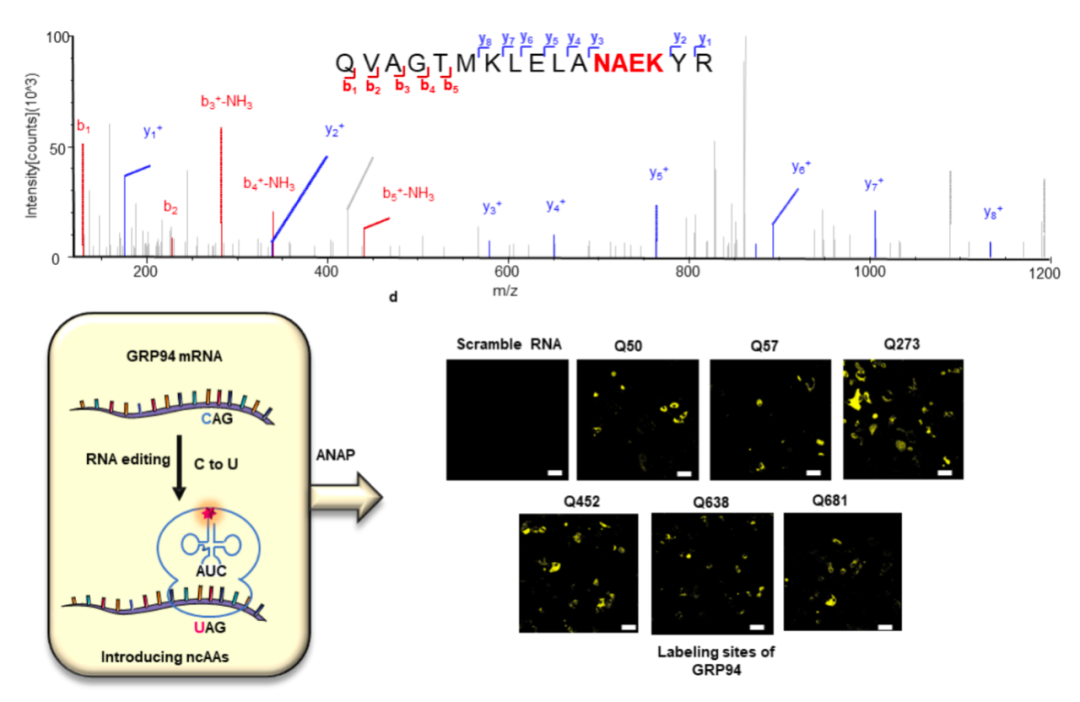
目前,常用的标记方法都有一定的局限性,例如抗体染色不能应用与活细胞,而小分子化学探针又缺乏通用型。目前最常用的是基因融合(使用荧光蛋白、自标记酶或肽标签),然而该方法通常需要过表达编码POI的开放阅读框架(ORF),可能对蛋白质的正常表达、折叠、定位和功能造成干扰。近年来,随着基因编辑技术的方法,通过基因编辑原位敲入编码荧光蛋白或特定标签的基因提供了高度精确的内源蛋白质标记方法。然而基因编辑方法可能对细胞造成致命或不可逆的影响,导致可能引起错误结论的人为现象。此外,在POI的基因序列编码的N-或C-末端附近进行标签插入的可编辑PAM位点通常对许多蛋白质不可用,限制了基于基因编辑的蛋白质标记方法的实用性。因此,亟需开发一种真正灵活和普遍适用的方法来标记内源蛋白,以填补现有蛋白标记技术的空白。2024年2月1日,北京大学刘涛团队在 Nature Chemical Biology 期刊发表了题为:Tracking endogenous proteins based on RNA editing-mediated genetic code expansion 的研究论文。该研究开发了基于RNA编辑介导的非经典氨基酸(ncAA)蛋白质标记方法——RENAPT,RNA编辑系统在不改变基因序列的同时,实现在目标蛋白mRNA水平引入终止密码子,且不受PAM序列的限制。然后通过非经典氨基酸系统,将荧光ncAA或具有生物正交反应手柄的ncAA进行后续染料标记在活细胞中,仅使用最小的氨基酸侧链标签,实现特异性地标记多种内源蛋白质(图1)。该研究扩展了内源蛋白标记方法,提供了一个广泛适用的平台,可以在活细胞中标记内源蛋白质,以研究其定位和功能。为了在活细胞水平实现内源蛋白的实时示踪,作者首先验证了RNA编辑系统实现C到U的编辑效率,然后通过肽段质谱,确认了ncAA可以位点特异性的整合到目标蛋白中。然后选择内源蛋白GRP94的不同位点进行了标记验证(图2)。直接观察蛋白质定位可以为研究蛋白质功能和相互作用提供重要的信息,因此,作者使用了一组已知亚细胞定位的内源蛋白,利用RENAPT系统进行实时标记。可以观察到目标内源性蛋白质(GRP94Q452UAG、ATP5AQ439UAG和IGF2-RQ506UAG)与各自的亚细胞定位荧光探针呈强烈的共定位信号(图3)。双标记系统在蛋白标记中的应用可以帮助研究人员更全面地理解蛋白质的功能、相互作用和定位。组蛋白H3.3a和H3.3b分别由H3f3a和H3f3b基因编码,它们在氨基酸序列上完全相同,但碱基序列不同。利用RENAPT系统,可以区分这2个蛋白,并对其分别进行标记,如图4a所示。通过使用双标记系统,研究它们在细胞内的定位。随后,研究团队对溶酶体蛋白IGF2-RQ506UAG和线粒体蛋白ATP5AR330UGA进行了双标记(图4b)。图4:RENAPT双标记系统。a. 双标记histone H3.3a-mCherry 和 histone H3.3b-eGFP蛋白. b. 双标记内源ATP5A 和 IGF2-R蛋白作者通过HIS-SIM超分辨成像系统对内源蛋白ATP5AQ439UAG、IGF2-RQ506UAG和GRP94Q452UAG进行超分辨成像(图5),得到了与相应的亚细胞荧光探针光谱重叠高度的共定位结果,PCC系数值在0.77-0.97之间。证明RENAPT系统可以用于超分辨成像的研究,可以帮助我们更清晰地观察和研究细胞器和亚细胞结构、更深入地理解细胞内蛋白质的结构和功能,并为生命科学研究提供更多的可能性。利用RENAPT系统,实现对神经细胞内源蛋白的高分辨率、高灵敏度和长时间的动态成像。Nav1.6负责神经元动作电位的起始和传导,并通过与ankG膜结构域相互作用而聚集在AIS远端。与ankG和Nav1.6抗体染色的共定位分析表明,RENAPT可以有效地标记Nav1.6(图6)。类似地, Cav2.1和NFL分别与对应的抗体和神经标记物微管相关蛋白2(MAP2)进行标记,研究共定位效果。这些结果证实,RENAPT可以成功地标记原代海马细胞中的内源性蛋白,这将有助于今后对它们表达、定位、相互作用和功能进行研究。该研究开发的RENAPT系统,跨越了传统的内源蛋白标记技术,直接在RNA水平实现对内源目标蛋白是实时示踪标记,扩展了内源蛋白质标记的方法,为更清晰地观察细胞结构和蛋白质分布提供了新的平台。文章首次结合RNA编辑与非经典氨基酸整合技术应用于内源蛋白标记系统,并且可以应用于神经细胞中目标蛋白的标记,期待未来科学家能够进一步拓展该系统在其他方面的应用。北京大学药学院博士后郝敏为论文的第一作者,研究方向为合成生物学、碱基编辑和基因密码子扩展技术等,博士生凌鑫宇和讲师孙懿为论文共同第一作者。北京大学药学院刘涛研究员为论文通讯作者。该研究获得中国国家重点研发计划、国家自然科学基金、国家科技重大专项计划、中国博士后科学基金和北京市自然科学基金等项目的支持。刘涛,博士,北京大学药学院博雅教授,博士生导师,分子与细胞药理系主任,天然药物及仿生药物国家重点实验室PI,化学生物学交叉中心PI,北大医学-惠大基因密码子创新联合实验室负责人。国家杰出青年基金获得者、国家海外高层次青年人才、国家自然科学基金获得者、国家优秀青年科学基金获得者、北京市杰出青年基金获得者。任中国医药生物技术协会委员合成生物学分会委员,中国生物医学工程学会青工委委员,获中国药学会以岭生物医药青年奖,拜耳研究员奖,北大王选青年学者奖等。以通讯作者身份在 Nature Chemical Biology、Molecular Cell、Nature Communications、Science Advances、JACS、Angew Chem、Chem等国际高水平期刊发表一系列研究论文。担任Journal of Molecular Biology编委,Chinese Chemical Letter编委等。研究集中在蛋白质药物化学修饰,基因编辑与细胞治疗,发展了含有人造氨基酸的蛋白质创新药物,应用在肿瘤及细胞治疗等多种领域,从而促进了生物药物的升级换代。www.nature.com/articles/s41589-023-01533-w
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。












发表评论
注册或登后即可发表评论
登录注册
全部评论(0)