 作
作

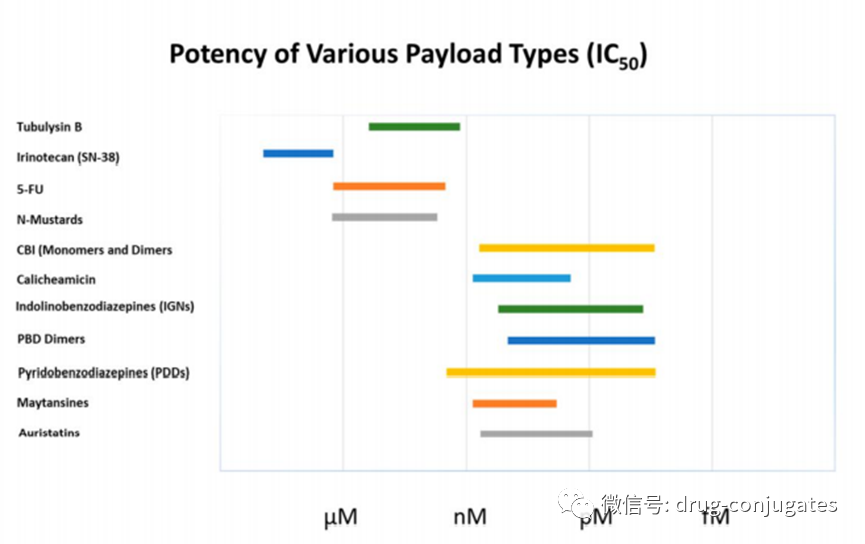
前期的开发的ADC使用的是FDA批准的抗癌剂的⼩分⼦Payload,例如多柔⽐星和长春新碱,但这些药物的毒性较差。由于ADC过大,估计只有2%左右的ADC被有效内化,因此毒性更高的Payload被开发为ADC的payload,其中⼤多数毒性太⼤⽽不能作为独⽴的治疗药物。因此良好的payload的IC50需要在低纳摩尔甚至皮摩尔区域,并具有良好的物理化学性质,例如可接受的亲⽔/疏⽔平衡和良好的稳定性。即:比常用的化疗药物(如阿霉素,紫杉醇,5-氟尿嘧啶,氨甲蝶呤等)毒性要高2~6个数量级!ADC的Linker不理想的稳定性造成药物提前释放尽量防止payload的过早释放,以减少对周围健康组织的损伤(尽管有时需要旁观者效应)。从商业和临床的⻆度来看,Payload分⼦也应该是化学上易于处理的,具有明确的放⼤⽣产和纯化手段。他们还应该拥有具有明确知识产权(IP) 和/或许可,且具有成本优势的合成路线。不同Payload的细胞毒性数据时需要考虑许多问题,包括⽤于评估它们的细胞系类型、孵育时间、每孔细胞的起始数量和使⽤的测定类型(例如代谢测定),例如 MTT 或
基于 ATP 的测定,例如 MTS),它们都可能影响IC50。因此,将不同Payload直接进行⽐较具有挑战性的。
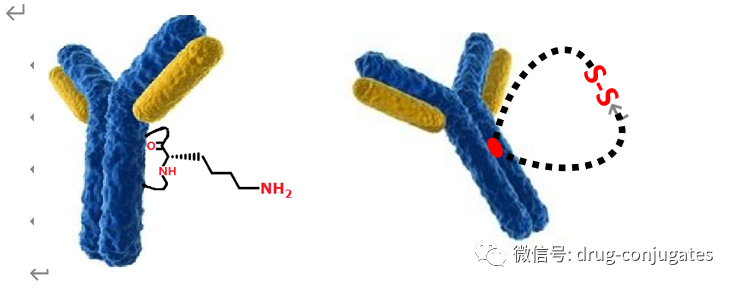
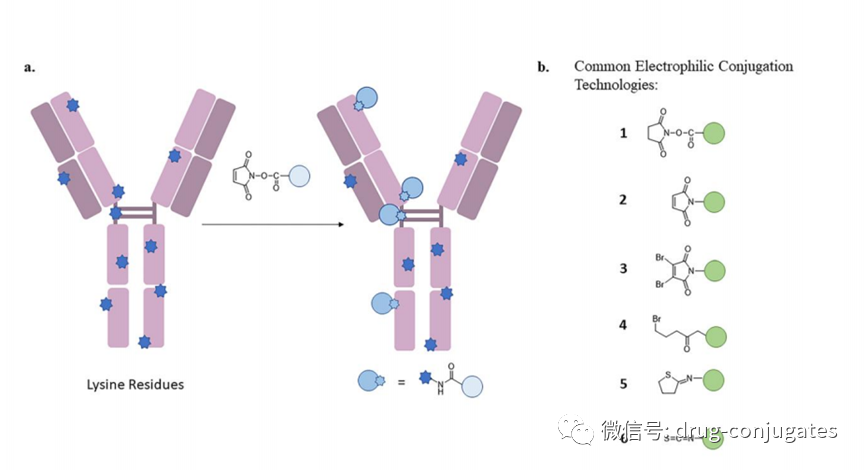
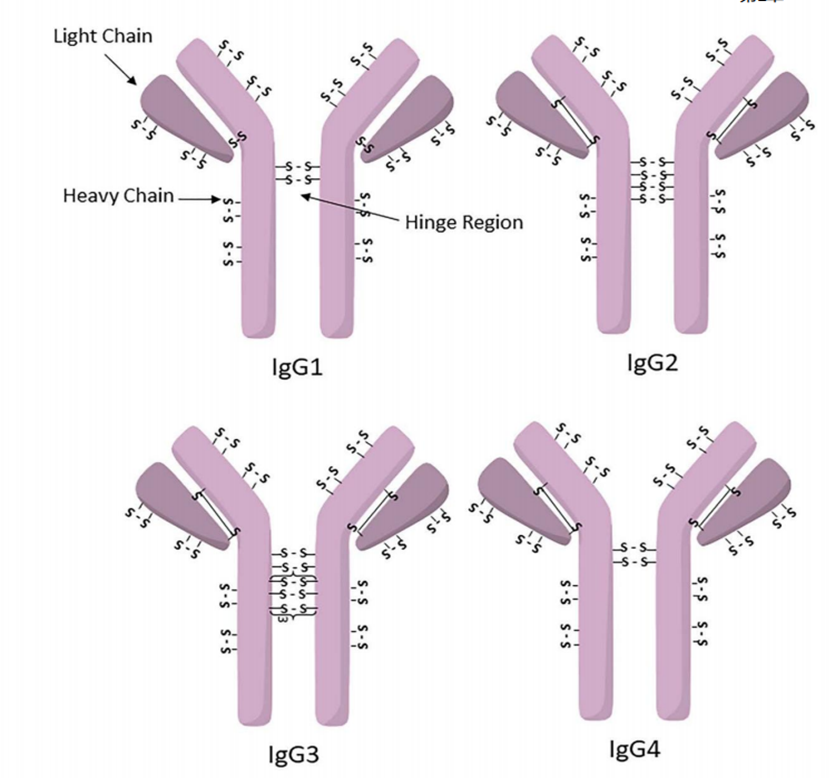
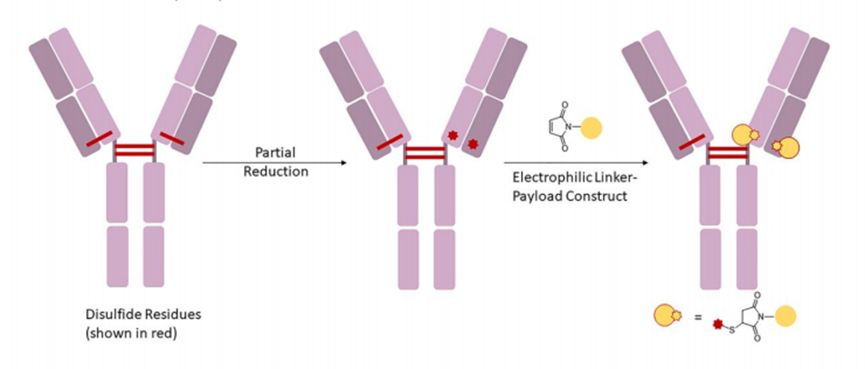
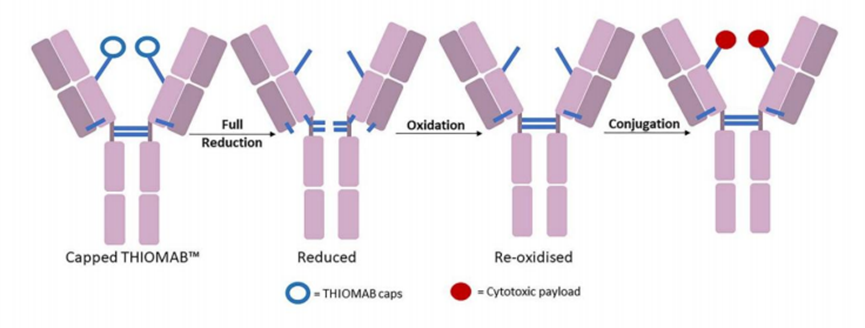
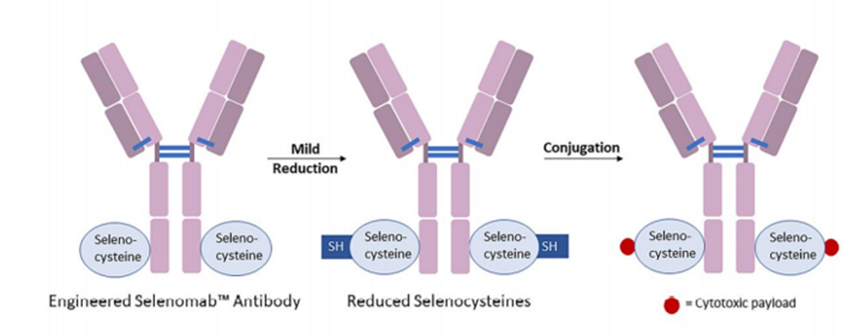
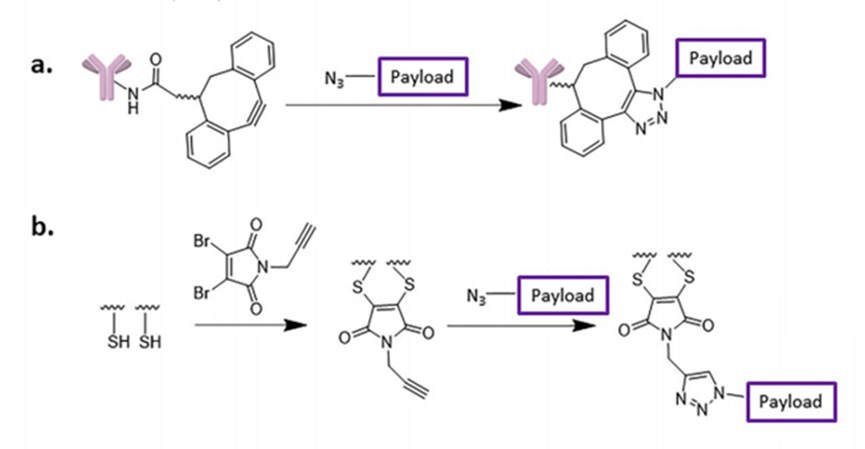
●每个单抗分子中约有80-100个赖氨酸残基,其中暴露在表面的赖氨酸残基至少30个已经开发了许多⽅法来将linker-payload连接到抗体上。开发的第⼀个缀合⽅法之⼀涉及位于Linker-payload末端的亲电⼦基团[例如,⻢来酰亚胺或N-羟基琥珀酰亚胺 (NHS) 部分] 与暴露的亲核 -NH2基团内赖氨酸残基的反应。这种 “随机”偶联方法导致ADC药物的异质性。后来通过初始或完全还原抗体的四个链间二硫键以产⽣平均数量(即,2、4、6、8)的亲核硫醇基团⽤于与亲电linker-payload的半胱氨酸偶联。尽管有所改进,但这种⽅法仍然导致ADC的不均一性[即,药物与抗体的⽐率 (DAR)为1-8],这可能对药代动力学、耐受性和有效性等参数产⽣负⾯影响。鉴于此目前已经开发了位点特异性偶联⽅法,例如 THIOMAB™技术。与赖氨酸残基的末端胺偶联是⼀种早期开发的偶联⽅法,由于抗体中存在80-100 个赖氨酸,因此选择性较低。整个IgG1抗体,以及它们与亲电⼦(⻢来酰亚胺)Linker-有效负载构建体的反应。(b) 六种最常⻅的亲电连接技术的结构:(1) NHS,(2) ⻢来酰亚胺,(3) ⼆溴⻢来酰亚胺,(4) 5-bromopentan-2-one,(5) Traut试剂和 (6) 异硫氰酸酯。由于赖氨酸暴露于抗体外,因此基于赖氨酸的偶联非常便捷,并且赖氨酸的氨基是良好的亲核试剂。目前赖氨酸偶联反应常涉及使⽤有效负载活化酯形成稳定的酰胺键。IgG1、IgG2 或 IgG4 等单克隆 IgG抗体包含多个⼆硫键,这些⼆硫键被认为是⼀种 均匀且同质的结构特征。经典的⼆硫键排列如下图所⽰。每个IgG 总共包含 12对链内⼆硫键,每对⼆硫键在抗体的不同区域。链间⼆硫键是细胞毒性Payload最理想的偶联位点。对于⼈ IgG1,四对链间⼆硫键通常在缀合前⽤三(2-羧⼄基)膦 (TCEP)、⼆硫苏糖醇 (DTT) 或 2-巯基⼄胺 (2-MEA) 等试剂还原。⼀旦⽣成了游离硫醇,它们就会与含有合适的亲电部分[例如⻢来酰亚胺、NHS、 3,4-⼆溴⻢来酰亚胺等的Linker-有效负载复合物反应,从⽽生成具有混合的 DAR 和不同位置的抗体偶联物。上图显⽰了部分还原 IgG1 抗体的⼆硫键以⽣成两个亲核硫醇基团的典型⽅法,这 些硫醇基团可以与亲电⼦Linker-有效负载构建体反应(即DAR = 2)(⻢来酰亚胺偶联)。对于 IgG1 抗体,最多可以还原四对链间⼆硫键,从⽽暴露最多八个亲核硫醇基团进行 偶联。基于还原剂生成硫醇的偶联会使⼆硫键完全或部分还原,使⽤这些⽅法⽣产的 ADC 每个抗体包含多达 8 个Payload(即,高达8 的 DAR),但对抗体的稳定性可能产生影响。由于二硫键的还原可能破环抗体的稳定性,也会产生不均一DAR值的ADC,目前已经开发了许多定点偶联来提⾼最终ADC产品的均一性。位点特异性偶联最著名的例⼦是基因泰克公司开发的 THIOMABTM 技术。THIOMABTM技术是利用具有改造的半胱氨酸残基的⼯程化抗体。这允许Linker-有效负载与特定的半胱氨酸发生偶联,⽽不会破坏链间⼆硫键。THIOMAB-有效负载结合物优于⾮位点特异性ADC,因为它们包含均匀分布的Linker-药物结构,通常 DAR 为2.与随机缀合的 ADC 相⽐,使⽤该技术制造的 ADC 是有效的,并且在许多体内研究中也显⽰出优越的安全特性, 特别是在肝脏和⻣髓毒性⽅⾯的优越性(PS:缺点是工程化改造的抗体产量偏低)。已经开发了其他位点特异性⼯程抗体。例如,Selenomab™ ADC 由 Scripps Research Insti tute(美国)开发,包含⼀个或多个特定位点的硒代半胱氨酸残基(下图)。硒醇基团的具有独特反应性,硒代半胱氨酸残基能够实现高效位点特异性缀合。与其他特异性偶联 ADC (天然和⾮天然氨基酸)相比,硒代半胱氨酸残基具有特别的反应性,允许在接近⽣理条件下进行快速、单步有效的反应。已使⽤多种点击化学⽅法将Payload附加到抗体上。在这种⽅法中,使⽤含叠氮化物 的试剂,例如(⼆氟烷基叠氮基)磺酸钠 (DAAS-Na),将叠氮化物基团连接到Linker-有效负载结构的末端。然后叠氮化物官能团可以与⼆苄基环⾟炔反应(DBCO) 反应偶联到抗体上(下图 a)。点击化学的⼀个优点是反应⾮常高效,反应条件温和,通常使⽤铜催化剂(PS:缺点是需要铜催化剂)。除了上述基于硫醇、胺或点击伙伴的众所周知的共轭⽅法外,还有其他基于醇的共轭技术(例如,可以形成碳酸酯、醚和酯)和醛[例如通过产生甲酰甘氨酸的酶 (FGE)]、工程氨酰-tRNA 合成酶 (aaRS)、氧化唾液酸和转氨试剂。此外,新的⽅法正在出现,例如Synaffix的 GlycoConnect™技术, 基于抗体上两个天然存在的聚糖锚点的初始酶修饰。然后使⽤⽆⾦属点击化学以特定位点的方式连接Payload分⼦(更详细阅读:基于糖基化的定点偶联技术)。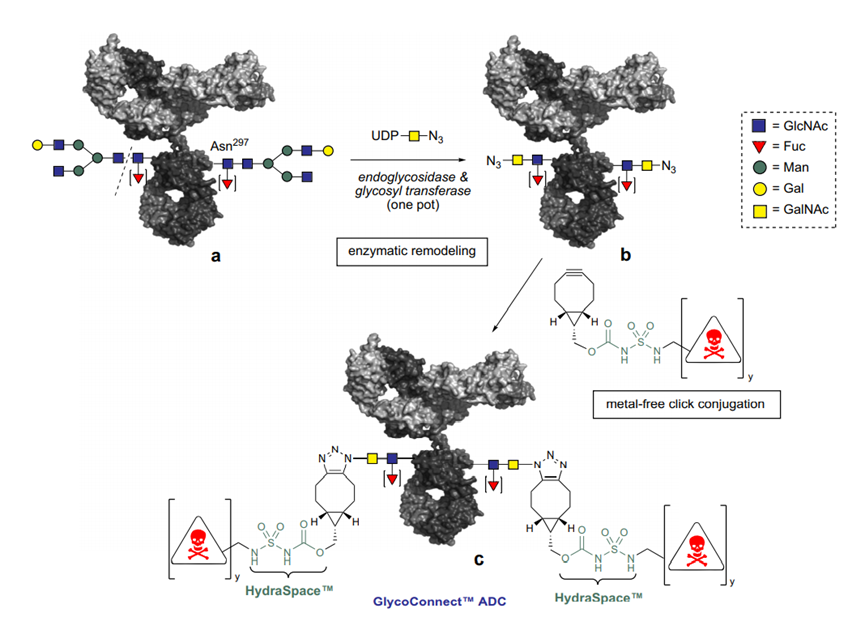
参考文献:
1.Cytotoxic payloads for antibody-drug conjugates
2.其它公开资料整理
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。
 作
作 







发表评论
注册或登后即可发表评论
登录注册
全部评论(0)