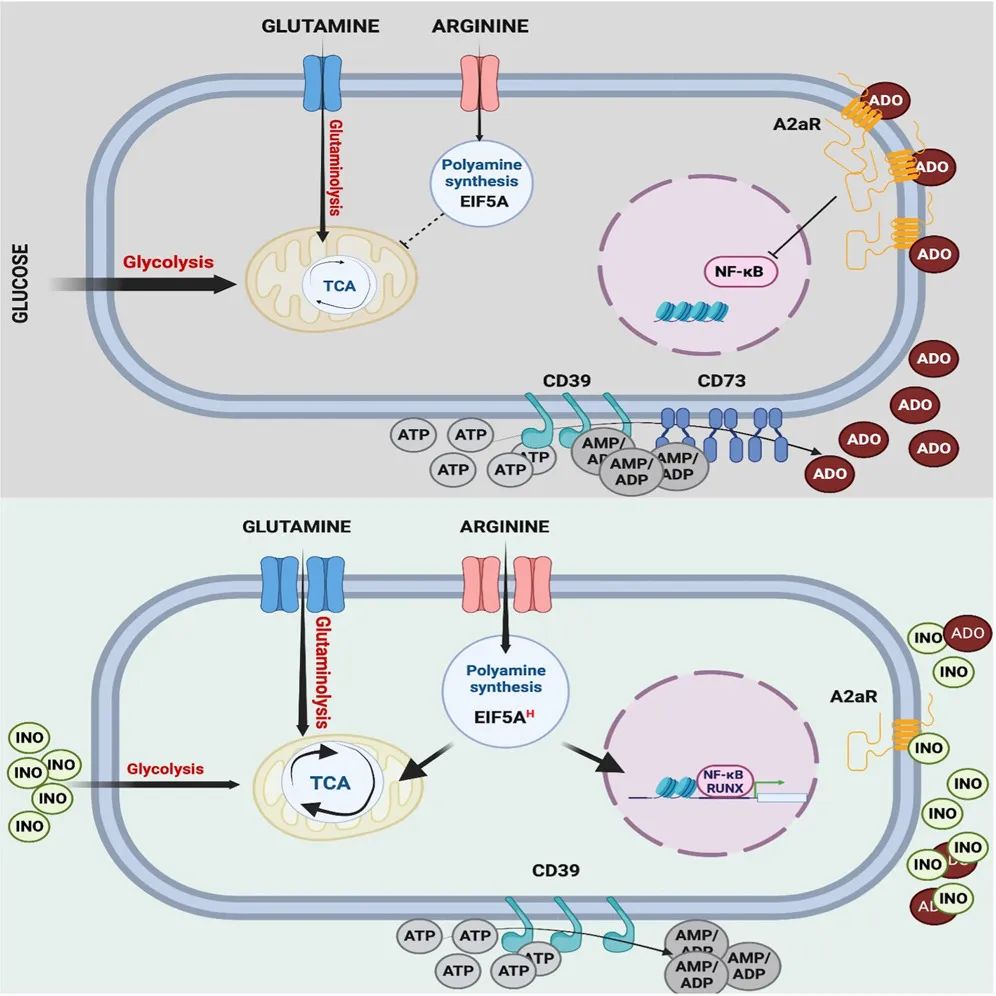
腺苷(Adenosine,Ado)是一种免疫抑制核苷,在肿瘤微环境(TME)中有助于免疫逃逸。CD39(由ENTPD-1基因编码)和CD73(由NT5E基因编码)将ATP代谢为腺苷,其主要通过A2aR信号传导介导免疫抑制。
小鼠CD4+Treg细胞共表达CD39和CD73,并通过产生腺苷来部分介导免疫抑制。在人类中,大多数Treg细胞表达CD39,而CD73的表达可以由缺氧诱导因子1-α(HIF1a)诱导。在肿瘤微环境(TME)中,肿瘤反应性T细胞富集在CD39+亚群中。虽然一些研究将预后改善与更高数量的CD39+肿瘤浸润淋巴细胞相关联,但功能研究表明,CD39标志着功能失调、耗竭的T细胞。
CAR-T细胞疗法对难治性B细胞恶性肿瘤具有很高的疗效,但对实体瘤的疗效较差,而T细胞耗竭是限制CAR-T细胞疗效的主要因素。
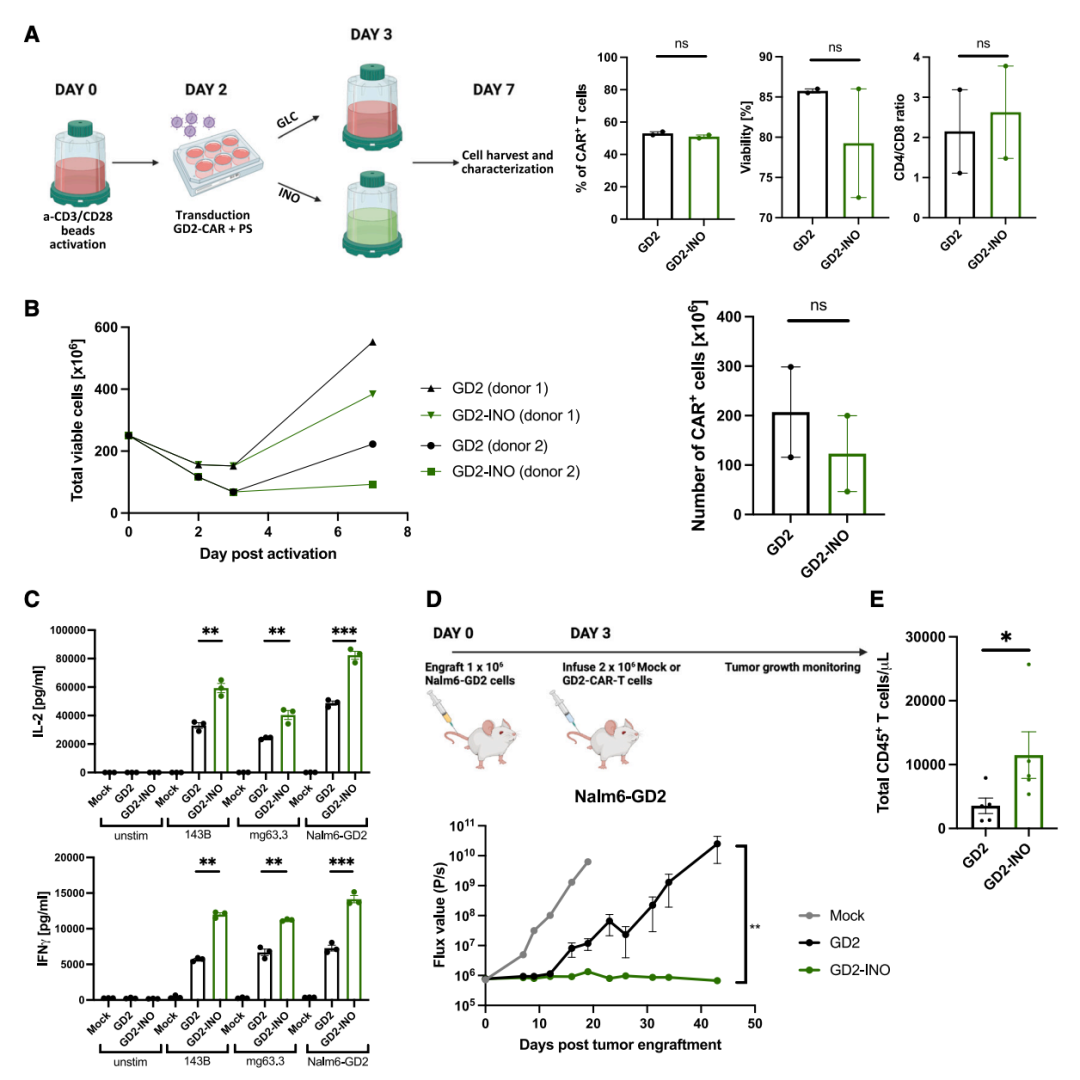
2024年1月25日,斯坦福大学医学院的研究人员在 Cancer Cell 期刊发表了题为:Inosine induces stemness features in CAR-T cells and enhances potency 的研究论文。该研究表明,肌苷(INO)是一种有效的T细胞干性诱导剂,可显著调节T细胞代谢、增强功能并诱导表观遗传重编程,INO还可用于制造效力增强的CAR-T细胞治疗产品,在肿瘤微环境(TME)中促进腺苷(Ado)代谢生成肌苷(INO)的方法,或是增强抗肿瘤免疫的有潜力的新方法。该研究探讨了CD39的生物学特性以及腺苷(Ado)在耗竭的人T细胞功能障碍中的作用,并试图通过工程化腺苷抵抗来增强CAR-T细胞的疗效。使用人CAR-T细胞耗竭的体外模型,研究团队观察到耗竭的CD8+ CD39+ T细胞共表达CD73,产生腺苷(Ado),并通过A2aR介导了Ado相关免疫抑制。为了诱导Ado抵抗,研究团队通过敲除了CD39、CD73或A2aR,试图以此增强CAR-T细胞功能,但仅观察到轻微的表型和转录变化。相比之下,过表达膜锚定的腺苷脱氨酶(ADA),将腺苷(Ado)代谢为肌苷(INO),显著改变了转录组向干性方向的转变,并增强了CAR-T细胞功能。同样,暴露于INO的CAR-T细胞诱导了干性相关基因的表达程序,并增强了CAR-T细胞功能。单细胞分析显示,肌苷(INO)诱导了深刻的代谢重编程,减少了糖酵解,增加了谷氨酰胺分解、多胺合成和氧化磷酸化,并重编程表观基因组向更大的干性方向发展。使用INO进行临床规模制造产生了增强效力的CAR-T细胞产品,满足临床给药标准,在动物模型中显示出增强的疗效。这些结果表明,INO是一种有效的CAR-T细胞代谢和表观遗传干性重编程调节剂,并为细胞制造提供了一个增强效力的平台。www.cell.com/cancer-cell/fulltext/S1535-6108(24)00008-4
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。







发表评论
注册或登后即可发表评论
登录注册
全部评论(0)