2021-08-26

今日,顶尖学术期刊《自然》在线齐发四篇重磅论文,为我们描绘了一幅关于人类胚胎发育的缩略图。通过追踪体细胞中出现的突变,我们终于能重塑这些细胞的家谱,给它们谱写出一部家族史。

《自然》杂志同期的评述文章指出,这一发现不但能提供关于细胞动态发育的洞见,还让我们重新思考癌症的遗传机理,有望改变我们对癌症的认知!
这四篇论文的共同点是利用体细胞的突变作为标志,追溯细胞的祖先,从而重建细胞的发育史。我们知道细胞在正常生长中,也会随机积累突变。这些突变会通过细胞分裂,遗传给自己的后代。
因此生长在不同器官、不同部位的细胞会带有不同的突变类型,这些突变就好像是指纹一般,讲述着它们独一无二的故事。通过对这些细胞进行测序,并对突变信息进行整理,我们就可以梳理出这些细胞的祖先一代一代分裂繁衍的历史。


在前两篇论文中,研究人员们从近期去世的成年人身上的不同组织里提取了相应的细胞,并根据体细胞突变来构建细胞的家族史。在追溯到最初的“分家”点时,他们发现这两条细胞分支对于人体组织的影响并不是相等的,而是可以有很大的区别。这就好像同一个家庭走出来的两兄弟,在未来会迎接不同的命运,迎来不同的生活。
《自然》的评述文章指出,这一发现与过去的研究结果具有一致性,且表明在早期发育阶段,细胞命运具有一定的随机性。

▲前两项研究的示意图(图片来源:参考资料[1];Credit:《自然》)
这两项研究还揭示了一些有趣的发现,比如一个受精卵经过三轮分裂,最初形成的八个细胞中,大约只有三个细胞会用来产生胚胎,而剩余的大部分细胞则会形成胚胎周边的组织,例如胎盘。
另外,研究人员们还发现在早期的胚胎发育过程中,体细胞会以很快的速度积累突变——在最初的几轮胚胎细胞分裂中,平均每一代细胞分裂,就会产生2.4个突变。直到细胞的DNA修复机制逐渐成熟,这一突变速率才会降下来。


在第三和第四篇论文中,研究人员们从不同器官中分离出了一些细胞,对突变的丰富性和多样性进行了分析。其中一项研究发现器官是否会自我更新,会对组成的细胞构成有很大的影响。比如小肠内壁的细胞由于会经常更新,它们的突变类型和遗传组成就很相似,因为它们来自共同的组织干细胞。相反,如果是大脑或者肌肉这类不大自我更新的组织,里头的细胞可以有明显的遗传差异,表明它们没有共同的近期祖先。
另外,这两篇论文也发现不同器官和组织中的突变,可能有着完全不同的来源。比如肠道细胞里的突变大多来自细胞分裂本身,而肝脏里的突变则受到外界毒素的影响。
值得一提的是,这些体细胞里的突变虽然大部分是中性的,但有一些突变会极大改变细胞的行为,驱动它们的生长。不过这些细胞最终能造成多大的影响,还要额外受其它因素的限制。比如器官和组织内如果具有微型的解剖结构,这些突变细胞的扩增就会限制在此类结构里。而倘若组织的结构是“一马平川”,那么这些带突变的细胞就会迅速占领大片面积。
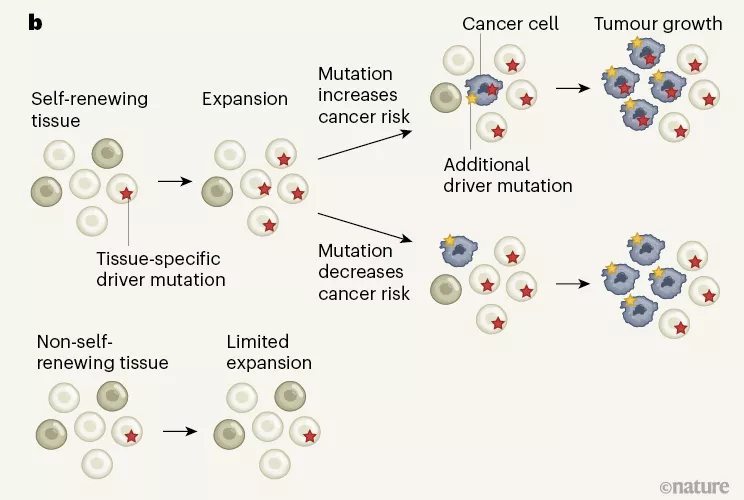
▲后两项研究的示意图(图片来源:参考资料[1];Credit:《自然》)
《自然》的评述文章指出,这四篇论文揭示了现代遗传学在解析细胞动态上的强大力量。更大规模的类似研究将让我们了解器官如何形成,也让我们理解不同突变会如何导致疾病。或许很多疾病的根源,在胚胎时期就已埋下了种子。
另外,这些发现也有助于我们更好地理解癌症。其实在这几项研究之前,科学家们就已经认识到健康的组织里也有很多突变,甚至是和癌症相关的突变,但这些突变并不总会驱动癌症的发生。研究人员们指出,这可能仅仅是因为这些突变是癌细胞从健康细胞里遗传来的,不代表它们就真的会引起癌症。
今日这四项研究中的一项也发现,在食道和直肠里,存在一些特定的组织,里头具有至少三处“致癌突变”。无独有偶,早期的一些研究也发现,在吸烟者的健康呼吸道细胞里,也存在至多三处驱动癌症的突变。《自然》评述文章提到,考虑到这些研究采集的样本数很少,如果很容易就能找到存在三处突变的细胞,那估计找到含有四处或五处“驱动突变”的细胞也不是什么难事,而这正是普通癌症细胞平均带有的关键突变数。
如果是这样,那是否可以说明,很多健康细胞都已经有了癌变的遗传基础,但却没有真正导致癌症的发生呢?如果那么多致癌突变都没有导致癌症发生,那又是什么导致了癌症呢?又或者,癌症不光要看是否带有突变,还要看这些突变细胞所处的环境?
显然,如果没有一个清楚的对照,这些问题是很难获得准确的答案的。只有结合不同的年龄、医疗历史、以及生活习惯等要素,获得更多健康组织的基因组信息,才能更好地了解癌症的发病关键。期望这一天距离我们已不再遥远。
本文题图:123RF
参考资料:
[1] Mutation fingerprints encode cellular histories, Retrieved August 25, 2021, from https://www.nature.com/articles/d41586-021-02269-0
[2] Coorens, T.H.H., Moore, L., Robinson, P.S. et al. Extensive phylogenies of human development inferred from somatic mutations. Nature (2021). https://doi.org/10.1038/s41586-021-03790-y
[3] Park, S., Mali, N.M., Kim, R. et al. Clonal dynamics in early human embryogenesis inferred from somatic mutation. Nature (2021). https://doi.org/10.1038/s41586-021-03786-8
[4] Li, R., Di, L., Li, J. et al. A body map of somatic mutagenesis in morphologically normal human tissues. Nature (2021). https://doi.org/10.1038/s41586-021-038
[5] Moore, L., Cagan, A., Coorens, T.H.H. et al. The mutational landscape of human somatic and germline cells. Nature (2021). https://doi.org/10.1038/s41586-021-03822-7
百度浏览 来源 : 学术经纬
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。




发表评论
注册或登后即可发表评论
登录注册
全部评论(0)