与其说是TIGIT的劫难,不如说同是一场国内创新药企业的劫难。百济首当其冲,直接打乱了百济进一步出海扩张的节奏。
2022年5月11日,罗氏公布 PD-L1+TIGIT治疗一线PD-L1高表达局部晚期或转移性非小细胞肺癌三期SKYSCRAPER-01临床试验的中期数据,该研究未达到PFS共同主要终点,另一个OS共同主要终点数据尚未成熟,需等待下一次的分析。

这一结果基本宣布TIGIT在该适应症的死刑。同时,2022 年 3 月 30 日,罗氏公开III 期 SKYSCRAPER-02 临床研究数据,抗TIGIT免疫疗法tiragolumab 联合 Tecentriq ®(atezolizumab)加化疗(卡铂和依托泊苷)作为广泛期小细胞肺癌( ES-SCLC )患者的初始(一线)治疗,没有达到PFS的共同主要终点。在其中期数据分析中OS 的共同主要终点也未达到,并且其最终分析也不太可能达到统计学意义。
TIGIT作为百济重点布局靶点,也收到牵连,当日美股跌近15%。
该靶点的失利,直接延缓百济进一步的出海节奏。打败K药变得越来越难。
PD-1推动了现代中国创新药企业的发展,在一定程度上缩短了企业的发展历程。在中国创新药企业的发展史中,PD-1起到了不可忽视的作用。可以说,没有PD-1就没有当下中国创新药企业的今天。一个靶点作用的能量就可以如此之大,TIGIT一度是被寄予希望的下一个PD-1。
中国抓住了免疫IO时代的脚步,并以此造就了国内三大Biopharma,百济,信达,君实。免疫联合用药逐步成为共识,百济迅速开启PD-1抗体联合TIGIT抗体的三期临床,位于国际第一梯队。
此次对于百济不说是重创,也算是非常不利的消息,直接斩断了百济进一步出海扩张的进程。同时,国内布局TIGIT这一靶点的企业,不胜枚举,几乎均有布局,是继M7824之后,又一惨败。
后PD-1免疫治疗时代遇冷
越来越多的证据,证明免疫联合治疗,是先前可能过于乐观,其实际效果,并不符合预期。后PD-1的免疫时代近乎遇冷。
CTLA-4抗体和PD-1/PD-L1抗体联用目前并没有充分的证据,证明联用对于PD-1抗体单药具有统计学意义的OS优势数据。不可否认,CTLA-4抗体有其疗效,但真要以OS作为标准,联用组未必能够跑赢PD-1抗体单药组。
LAG-3作为既PD-1之后,又一重磅免疫检查点。2022年3月18日,FDA批准LAG-3抗体组合疗法,Opdualag,治疗黑色素瘤。与nivolumab 单药治疗相比, Opdualag的中位 PFS 增加了一倍多 ,分别为 10.1 个月与 4.6 个月;(危险比 [HR] 0.75;95% CI:0.62 - 0.92,P = 0.0055)。Opdualag组的 3/4 级药物相关不良事件为 18.9%,而 nivolumab 组为 9.7%。Opdualag组导致停药的药物相关不良事件为 14.6%, nivolumab 组为 6.7%。而Opdualag组合疗法相比O药单药疗法在OS方面是没有达到统计学意义的。为扩展其它适应症,留下了很大隐患。黑色瘤有其特殊性,带瘤生存本身的生存期就很长,仅PFS数据批准有其合理性,但其它适应症,是需要另做考虑的,OS或许就是不得不去考虑的标准。
PD-L1×4-1BB双抗连连失利。Merus作为国外双抗研发的代表,2022年1月25日,Incyte宣布终止与其MCLA-145(PD-L1×4-1BB双抗)的合作。MCLA-145本身存在很问题,安全窗口及治疗窗口极窄,大于25mg给药量才有初步疗效,50mg,75mg就已毒性明显。只能以25mg作为RP2D,但一期临床试验中,50mg才有一例PR,25mg剂量组并未出现PR。这一药物注定失败收场。同时,Genmab的PD-L1×4-1BB双抗 (GEN1046),也并不理想,疗效不佳,且疗效跟剂量没有依赖关系。
CD40抗体联用PD-1抗体不及PD-1抗体单药,未能体现联用效果。2021年5月,Apexigen在ASCO 2021年年会上公布了CD40抗体Sotigalimab (APX005M)用于治疗转移性胰腺癌联合用药的2期临床数据。APX005M联用吉西他滨/白蛋白紫杉醇标准疗法,1年总生存期的临床获益为48.1%(P=0.062,n=36),历史标准疗法对照组数据为35%。同时,Nivolumab联用化疗组1年总生存期的临床获益为57.3%(P=0.007,n=34)。Nivolumab,APX005M联用化疗组1年总生存期的临床获益为41.3%,且(P=0.236,n=35)。仅Nivolumab联用化疗组有明确的OS改善的统计学意义。表明APX005M与PD1抗体Nivolumab联合化疗组,未能达到Nivolumab单药联用化疗组的治疗水平。
同时,Nektar偏向性IL-2联合PD1抗体临床失败,也未能体现出联用效果。2022年3月14日,百时美施贵宝 (Bristol Myers Squibb) 和 Nektar宣布偏向性IL-2(Bempegaldesleukin)联合PD-1抗体Opdivo治疗转移性黑色素瘤的三期临床未达到PFS和ORR的主要终点。
后PD-1免疫治疗时代遇冷,ADC,细胞治疗逐渐走到台前,成为主力。ADC赛道
第一个ADC(Mylotarg)于2000年获得批准,自2019年以来,获准的ADC数量翻了一番多,2019-2020年共有5个ADC获得批准,2021年批准了2个。
可见,大分子领域,ADC是相对靶点成药性较高的。且疗效,也十分明显。
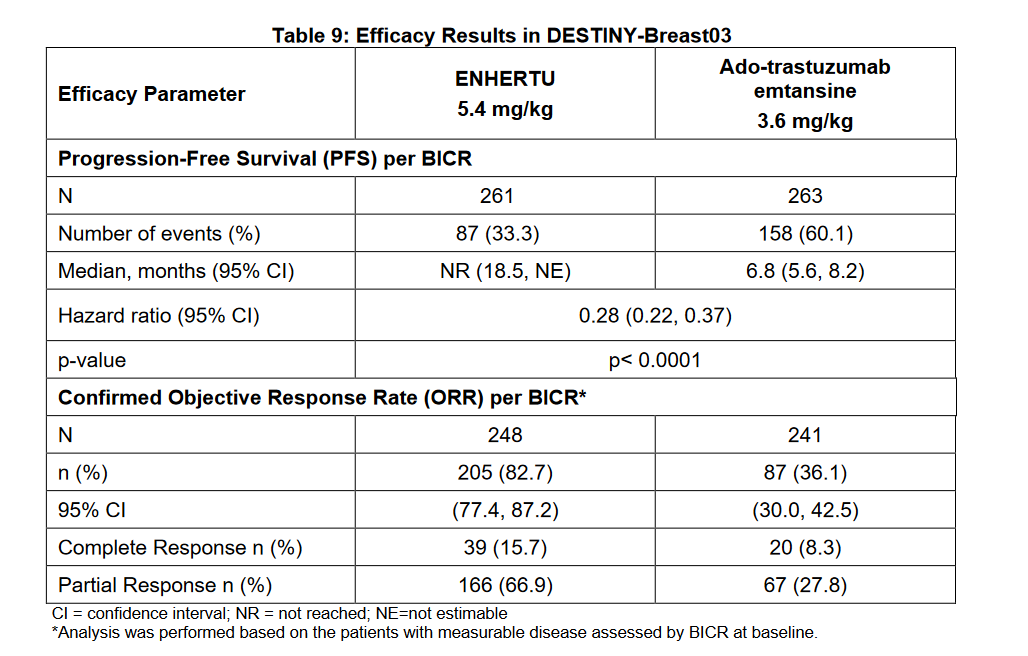
Enhertu(DS-8201)的成功,将ADC研发的热度带上高潮。在DESTINY-Breast03临床实验中,以优异的疗效碾压式打败, 结果显示,与T-DM1相比,Enhertu将疾病进展或死亡的风险降低了72%。该结果同时也支持将Enhertu的加速批准转为常规批准,并纳入《NCCN指南》。Enhertu 的ORR 为 82.7%,T-DM1ORR仅为36.1%。
目前,ADC 采用的payload趋势大都开始参照第一三共的DS8201,采用DXD或者类似物。国内恒瑞,普方,正大天晴,康宁杰瑞等众多公司,都已经有相关payload的ADC的管线在开发。而国际上,2022年2月15日,Immunogen宣布与礼来达成合作协议,承诺授权给礼来多款Immunogen新型喜树碱ADC技术开发的ADC新药。根据协议,礼来制药就首个选定靶点支付预付款1300万美元,若礼来选定额外靶点,则再支付3250万美元。此外,礼来还需要支付最多17亿美元的里程碑金额及一定比例的销售分成。
DXD逐渐成为国际趋势。但不同适应症可能适用不同的毒素。所以,同一靶点不同毒素的ADC,可能会因适应症的不同,并不容易区分孰优孰劣,双毒素ADC的开发,成为一种潜在的选择趋势。
细胞治疗赛道
细胞治疗还是偏向于血液瘤的治疗。通用型CAR-T有了一定进展。
2022年5月12日,Caribou Biosciences公布其通用型CAR-T候选产品CB-010的初步临床试验数据,在5例可评价侵袭性复发/难治B细胞NHL患者中,均有响应,ORR达到100%(5/5),其中4例患者完全缓解,CR达到80%(4/5)。
T细胞根据其受体(TCR)表达种类的不同,大概可以分为两类:一类是表达αβTCR的T细胞,主要参与适应性免疫应答;另一类是表达γδTCR的T细胞,主要参与固有免疫应答。αβT细胞占T细胞总数95%以上,其T细胞受体由α链(TRAC基因编码)、β1链(TRBC1基因编码)和β2链(TRBC2基因编码)构成。Caribou 采用高效率的特异性更强的CRISPR/Cas12a技术,敲除TRAC基因,避免GvHD,同时将CAR目的基因插入到TRAC位点。2017年2月,《自然》期刊发布“Targeting a CAR to the TRAC locus with CRISPR/Cas9 enhances tumour rejection”的文章,表示在该位点插入CAR基因,静息信号较低,且在抗原重复刺激后,能够保留更多的中央记忆T细胞表型,并且相比传统CAR-T和其它插入位点的CAR-T(例如B2M)具有更好杀伤肿瘤活性。同时,CB-010,敲除了PD-1,增强T细胞抗肿瘤的持久性。
通用型CAR-T最大的隐患在于其安全性,安全性方面CB-010的耐受性良好,没有观察到GvHD,大多数AE在1级或2级,没有2级及以上CRS,仅1例3级ICANS(定义为DLT,接受IL-6R抗体和类固醇治疗后逆转)。

同时,Caribou 还在开发CAR-NK管线。
NK细胞相比T细胞更具有现货属性,不会发生GvHD,安全性更高。NK疗法对于血液瘤也有较大突破。2022年4月10日,Affimed公布了AFM13(CD16A/CD30双抗)预混脐带血来源的NK细胞疗法临床试验结果,ORR为100%,CR为62%。没有观察到细胞因子释放综合征、免疫效应细胞相关神经毒性综合征或移植物抗宿主病等副作用。无剂量限制性毒性,RP2D为10^8 NK/Kg,安全性好。Affimed开创的这一疗法,可以称之为现货疗法,相比于传统CAR-T/NK省却了慢病毒转染这一步骤。AFM13 的阶段性成功代表了 Affimed 的一个重要里程碑,也标志着固有免疫肿瘤学领域转折点的到来,为将这种方法扩展到其他癌症适应症奠定基础,同时为联用疗法提供了无尽的想象空间。
CAR-T对于实体瘤的治疗,还没有确切地得到突破性的答案。科济CT041在既往接受至少2线治疗失败、接受II期推荐剂量(RP2D) 2.5×10⁸ CAR-T细胞治疗的18例胃癌/胃食管结合部癌患者中,8例(44%)患者既往接受过抗PD-(L)1单抗治疗。中位随访时间为输注后7.6个月,ORR为61.1%,DCR为83.3%,中位PFS和中位OS分别为5.6个月和9.5个月。
看似非常优异的疗效,实则与在CAR-T治疗期间频繁使用化疗药物脱不开关系,而且没有一例完全缓解,全为部分缓解。考虑到化疗药物,如白蛋白紫杉醇联用CAR-T,有助于T细胞对于肿瘤微环境的浸润,可能会有更好的响应能力,但其OS仅为9个月左右。个体化CAR-T药物是非常昂贵的,多则百万,少则几十万,去买几个月的生命,普通百姓可能要考虑其收益比。
科济CT041在科学层面或许有一定意义。但实际效果未必理想,并不能排除频繁使用化疗对于CAR-T药效的误导影响。同时作为非通用型个体化CAR-T价格十分昂贵,推广难度也大。
对于通用型CAR-T国内也都在布局,和ADC一样,都要面临专利问题。怎么去避开专利,或者去引进专利,都是不得不在下一步所去面对的。
国内CAR-T布局,相对于国外并不落后,如南京传奇,科济等都有亮眼的布局,其中南京传奇,做出了一款举世瞩目的best in class,BCMA CAR-T疗法cilta-cel,证明了中国科研工作者的实力。
ADC的布局,国内也并不落后。这两个赛道,对于国内还是较为乐观的。未来,PD-1抗体联用ADC,或许会成为打败K药的一种选择。肿瘤治疗领域,所有的目标,就是打败K药,或者在PD-1抗体耐药患者中,效果优异。 版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。










发表评论
注册或登后即可发表评论
登录注册
全部评论(0)