原发性肝癌包括肝细胞癌、胆管细胞癌和混合型肝细胞癌 — 胆管癌。其中,肝细胞癌的发病率占比最高( 75% ~ 85% ) 。以下的“肝癌”仅指肝细胞癌。基于大宗病例的数据以及临床诊疗区隔出现,虽然中晚期肝癌患者整体OS不令人满意,但在目前缺乏有效的治疗手段的情况下,手术切除仍然可以实现部分患获益。多个指南共识推荐为了实现提高肝癌患者5年生存率,要以手术为主的综合治疗策略。目前,无论新辅助、转化、辅助治疗的目的是实现
术后复发率低
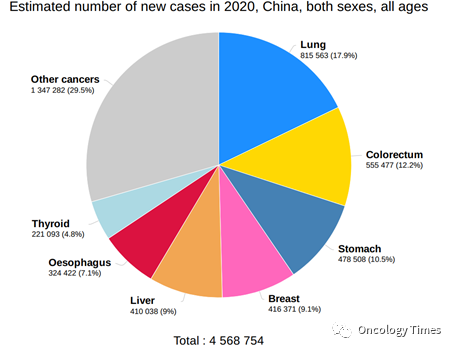
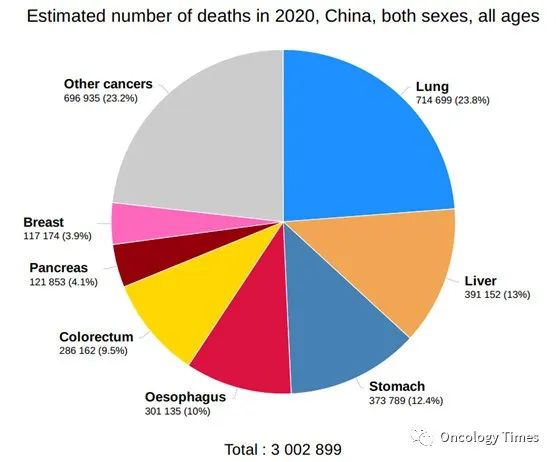
延长生存获益。新辅助和转化大量研究正在探索阶段,辅助治疗目前有多数注册II期以及III期临床研究正在进行。对于分期较晚、肝功能较差、肝外转移的术后复发患者,主要推荐系统抗肿瘤治疗。GLOBAL CANCER 最新数据显示,肝癌发病例数接近死亡病例数。而基于肝癌领域的基础和临床研究取得的突破性进展,免疫治疗、靶向治疗等系统抗肿瘤方案的日新月异发展,发病率和死亡率呈整体下降趋势。1)对于中早期的肝癌术前治疗是为改善病人生存减少复发,转化治疗是否开展仍需要临床研究证实2)对于中晚期可切除的肝癌,转化治疗可以将肿瘤学特征较差的肝癌转化为肿瘤学特征较好的肝癌,从而减少术后复发,延长生存3)积极探索:单药或联合TKI/ICI新辅助治疗初步成效举例:2020 年 ASCO 报道 (未发表数据)新辅助治疗的研究,入组可切除的肝癌患者 30例,术前使用3周期的纳武利尤单抗联合伊匹木单抗或纳武利尤单抗单药治疗,术后发现病理完全缓解 (pCR)
率达 24%,主要病理缓解率达16%,没有导致手术推迟或取消的毒性反应发生。该研究整体 40%的病理缓解率为免疫治疗
在 可 切 除 肝 癌 中 的 新 辅 助 治 疗 奠 定 了 基 础 。Ahmed Omar Kaseb, et al. 2020
ASCO Abstract 4599肝功能差FLR不足的外科学不可切的通过抗病毒保肝治疗改善肝功能实现可切除。
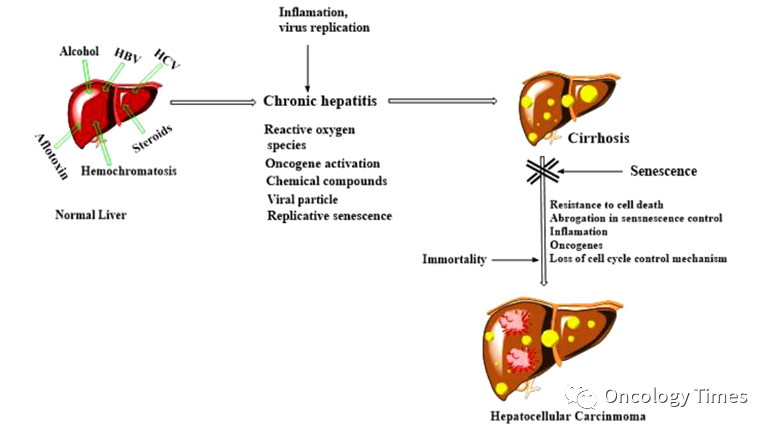
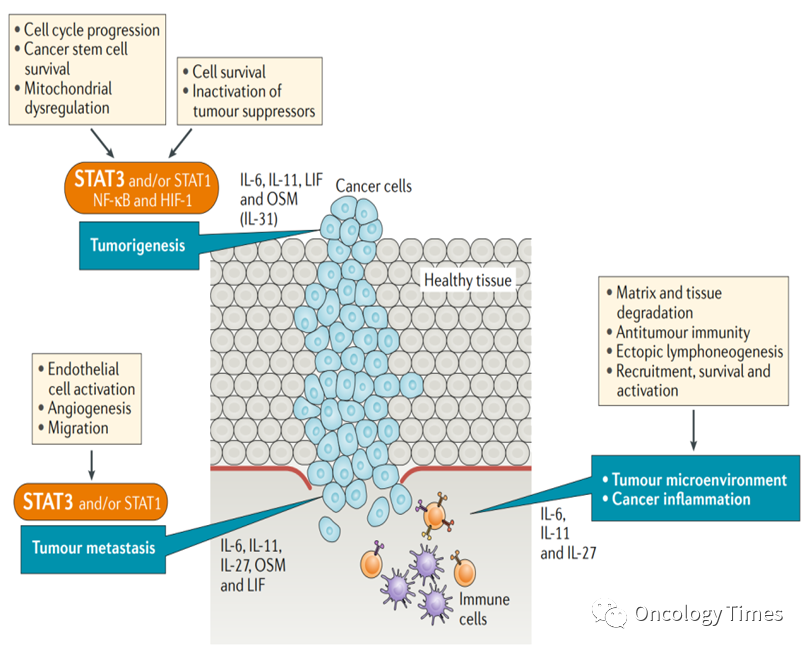
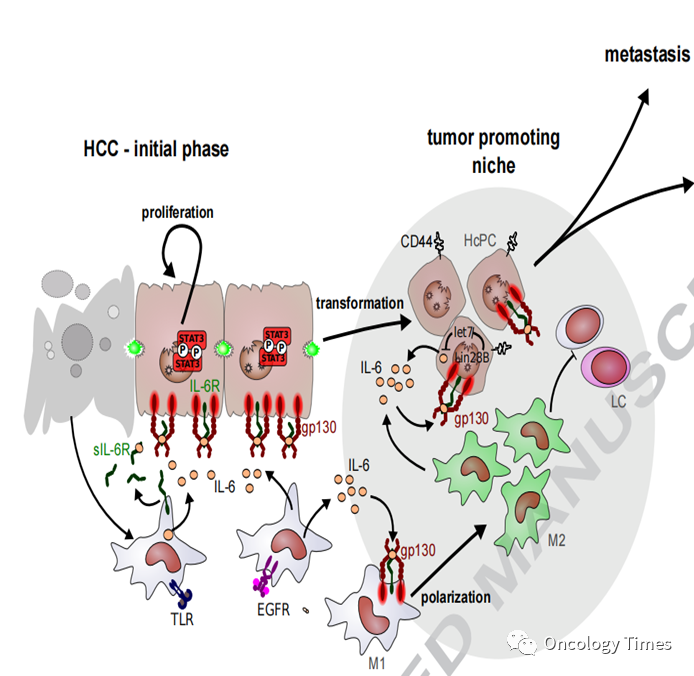
对于肿瘤分期较晚 同过系统抗肿瘤治疗或局部治疗实现可切除。据大量文献报道,局部联合系统治疗以及局部联合局部治疗及靶向免疫联合治疗的总体转化切除率在10%-50%之间。TACE+HAIC的转化切除率为 48.8%。Li B, et al. Annals of Surgery Open, 2021虽然术前新辅助和转化治疗方面已取得一定的突破,但对于手术切除的患者,术后高复发仍是肝癌外科治疗的瓶颈。既往研究表明,HCC切除术后5年肿瘤复发转移率高达40%-70%,其中存在高危复发风险因素的患者,术后复发率更高,5年复发率甚至超过80%。外科操作、临床病理因素和背景肝病因素都会导致术后复发转移,例如 手术切缘宽窄、多发性肿瘤(≥3个)、MVI、AFP2月术后未降到正常水平等等三种形式:原发灶肝内肝外转移、残存病灶进展、新病灶的出现。无论术后肿瘤复发形式如何,从肿瘤的特征来看,肿瘤的发生发展涉及多种机制,如血管生成、组织浸润、肿瘤促炎症作用和免疫逃逸等。特别的,肝细胞癌是一种高度炎症相关的肿瘤,在肝癌的整个发生发展过程中都伴随着持续的炎症反应,其中炎症细胞因子TNF-α、IL-6等,肝癌致癌相关通路如NF-kB、JAK/STAT、PD1/PDL1s等都参与其中。其中IL6是HCC生长主要驱动因子,通过STAT3 信号通路实现肿瘤生成、转移等发挥作用,而IL6是由库普弗细胞激活后分泌的。HCC祖细胞Hcpc通过LIN28B上调获得自分泌IL-6回路通路,离开微环境,形成HCC结节转移到远处。
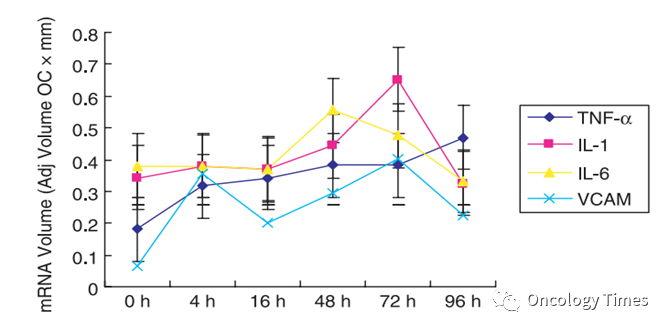
图片1来源:Arsura M, Cavin LG. Cancer Lett. 2005 Nov 18;229(2):157-69.Meng Y, et al. Cancer Res. 图片2来源:2021 Jun 1;81(11):3036-3050.NF-kB的激活是肝癌进展的早期关键事件,TNFa 参与NF k 的激活,促进肝癌的发生。并且通过核糖核蛋白RNA蛋白酶信号通路诱导肝前提细胞的恶性转化。基础研究表明,肝癌切除术4h后TNF-α的表达立即增加,并保持高水平至96h。促炎细胞因子TNF-α、IL-1β、IL-6和VCAM-1的表达与切除术后肝转移的增强相关。图3来源于 Bai L, Mao GP,
Cao CP. J Dig Dis. 2007 Aug;8(3):154-9. 除此之外,高AFP水平(>400ug/L),以及术后未降至正常水平 都是肝癌术后的风险因素。对于存这些AFP大于400,IL-6/TNF-α高表达等
高危因素存在复发高危风险因素的患者,指南推荐采用术后辅助。原发性肝癌诊疗指南(2022年版)推荐:证据等级 1,推荐 A:TACE、抗病毒治疗、槐耳颗粒 ;但肝癌的辅助治疗有很多问题值得进一步探讨:- 术前如何准确筛选/预测辅助治疗最适合/收益最大的患者,避免无效用药及加重患者经济负担,甚至丧失手术机会?
- 哪种辅助治疗方案转化效果最佳,对患者全身及肝功能、手术作影响最小?
- 对于 IIb、IIIa期交界性可切除肝癌,先行转化治疗再手术还是先手术再加上辅助治疗,哪一种案的长期效果更好?
- 如何避免积极的术后辅助治疗,造成严重的全身或者肝脏不良反应,从而降低肝癌复发后的再次手术或者局部治疗的安全性,甚至失去再次治疗机会?
1)现有的肝癌靶免治疗药物主要适用于CP
A级患者缺乏CP
B级患者的疗效数据
二线:瑞戈、阿帕、卡瑞利、替雷利、雷莫芦(国内未获批);
2)肿瘤开始对于免疫治疗是有响应的,但是治疗一段时间后,肿瘤耐药,开始复发或者进展。纵观整体来看肝癌一线系统治疗PFS仅为3.7-7.4个月。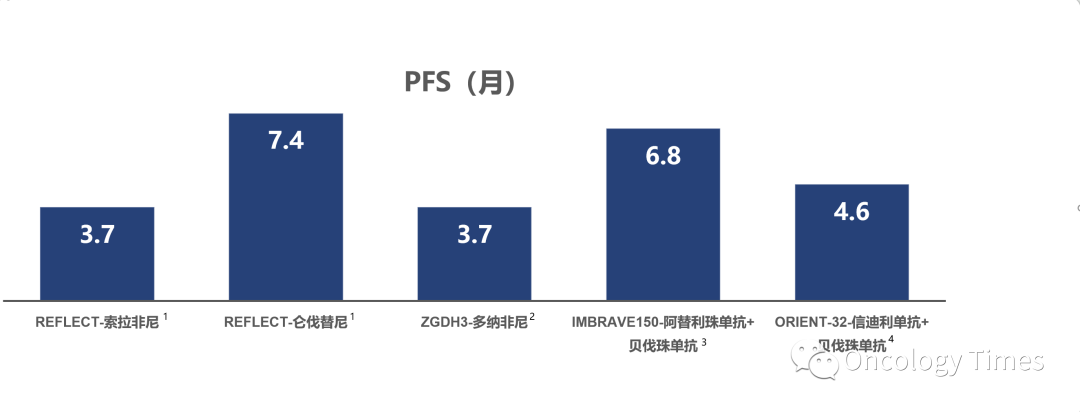 大量研究证实 ,IL-6和TNFα的高表达会促进HCC细胞对靶免药物耐药:IL-6 :
大量研究证实 ,IL-6和TNFα的高表达会促进HCC细胞对靶免药物耐药:IL-6 :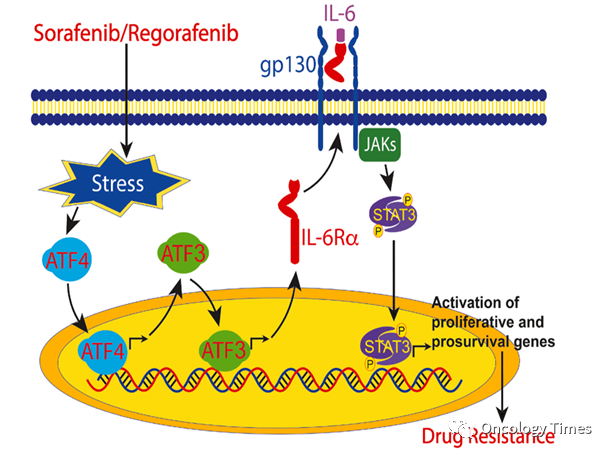 L-6/JAKs/STAT3是诱导TKI耐药关键通路, 抑制IL-6可增加肝癌细胞对TKI的敏感性Dai Z, et al. Cancer Lett. 2022 Jan 1;524:161-171.
L-6/JAKs/STAT3是诱导TKI耐药关键通路, 抑制IL-6可增加肝癌细胞对TKI的敏感性Dai Z, et al. Cancer Lett. 2022 Jan 1;524:161-171.
Tan W, et al. EBioMedicine. 2019 Feb;40:446-456.除了耐药,因不良反应发生所致的药物耐受性差也是影响治疗效果的重要因素。目前,系统化治疗仍然还有许多新的挑战摆在面前,例如以靶向、免疫为基础的系统治疗疗效已遭遇瓶颈期,肝癌患者的生存获益边际效应减弱,迫切需要有突破性的全新治疗方法的出现。这需要各个学科和多中心的通力合作,在新版肝癌诊疗指南的指导下,努力开展有创新意义的基础研究和大规模高质量的多中心临床研究,进一步提高我国
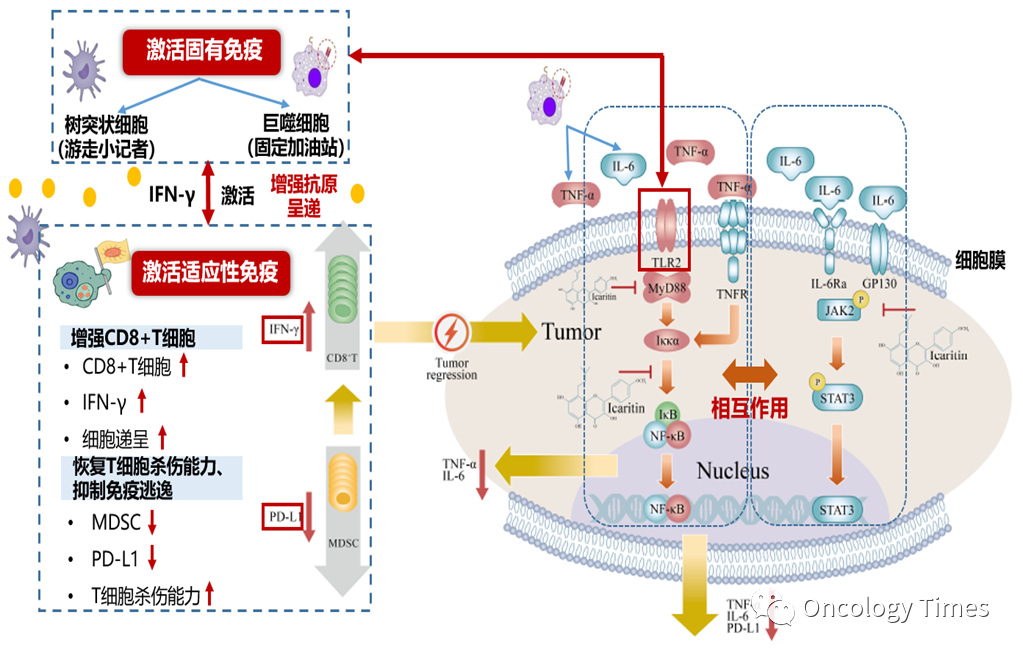
肝癌的诊治水平。对于拒绝接受标准治疗且不适合接受标准治疗,且肝功能差的患者来说,亟需寻找安全性高,耐受性好的治疗方案,实现与靶免协同增效的同时,减少术后复发转移,延缓靶免的耐药。于2022年1月10日,Icaritin 获得国家药品监督管理局(NMPA)批准,用于不适合或患者拒绝接受标准治疗,且既往未接受过全身系统性治疗的、不可切除的肝细胞癌(HCC),患者外周血复合标志物满足以下检测指标的至少两项:AFP≥400 ng/mL;TNF-α<2.5 pg/mL;IFN-γ≥7.0 pg/mL(详情点击链接Icaritin Versus Cinobufotalin 一线治疗晚期肝癌的疗效和安全性。)该适应症获批是基于一项多中心、随机、双盲、平行对照的III期临床研究---SNG1705 ICR-1研究,且III期临床试验期中分析有效性结果显示,主要疗效指标总生存期(OS)在富集人群中,相比于对照组来说,mOS及95%CI分别为13.54m(7.36,20.07)vs 6.87m(4.93,11.43),p=0.0092; 据大量研究报道,在肿瘤细胞中,Icaritin可以下调TNF-α、IL-6、PD-L1等表达发挥抗肿瘤作用 ,同时通过下调TNFa 和IL-6的分泌量以及MDSC细胞比例抑制PDL1的表达实现对肿瘤免疫微环境的调节作用。(References: Martínez-Sabadell A, et al. Clin Cancer Res.
2022 Apr 1;28(7):1243-1249/Fan Y, et al.
BMC Cancer. 2019 Mar 28;19(1):279./Tao H, et al. Front Immunol. 2021 Feb 26;/12:609295. Hao H, et al. Eur J Immunol. 2019 Dec;49(12):2235-2244)国内肝癌治疗领域两大权威指南-《原发性肝癌诊疗指南》2022版,《CSCO原发性肝癌诊疗指南》2022版均推荐Icaritin用于晚期肝癌治疗。CSCO指南推荐Icaritin 用于晚期HCC一线治疗(1B类证据),对于肝功能较差的患者Ⅰ级推荐。对于较晚期患者,推荐系统抗肿瘤治疗,但现有系统治疗药物主要适用于CP A级患者,且存在耐药、耐受性差的问题;对于CPB级别既往没有特别好的药物获批,2022版本指南更新了这部分患者的用药选择,CP B级以及C级的患者指南也推荐Icaritin。肝癌强调多种治疗方式共存,多学科的综合联合治疗已经获得诊疗领域专家的共识。目前,晚期HCC化疗靶向治疗进展缓慢,对于靶免不耐受以及肝功能CP B级别的患者来说Icaritin是新选择。因毒性低不良反应低,为更多治疗方案的联合带来可能。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。

 L-6/JAKs/STAT3是诱导TKI耐药关键通路, 抑制IL-6可增加肝癌细胞对TKI的敏感性
L-6/JAKs/STAT3是诱导TKI耐药关键通路, 抑制IL-6可增加肝癌细胞对TKI的敏感性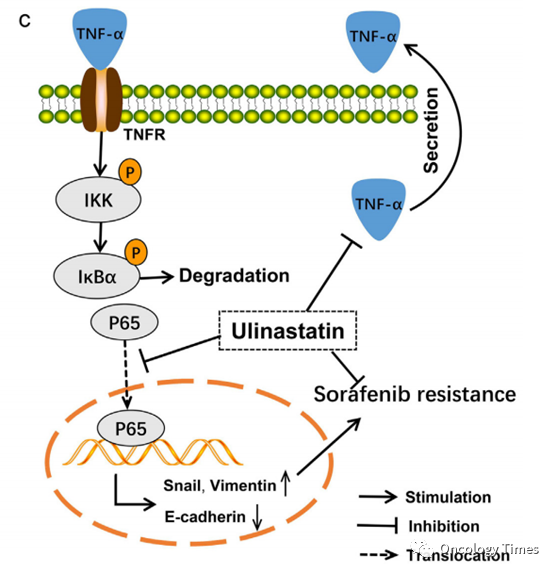







发表评论
注册或登后即可发表评论
登录注册
全部评论(0)