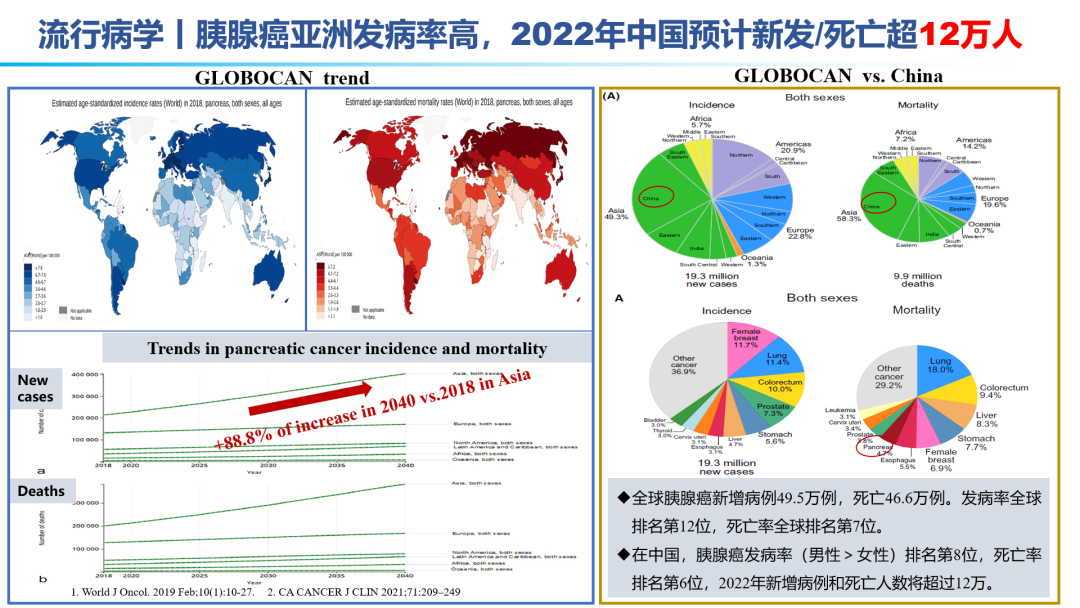
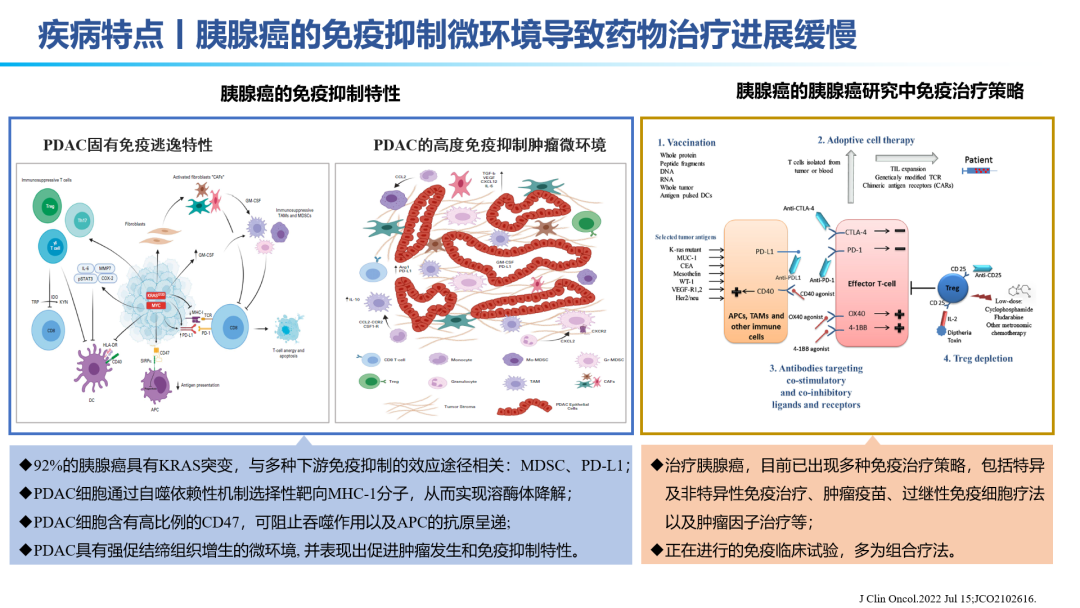
胰腺癌亚洲发病率远高于全球的发病率,有机构预测,从2018年到2040年,胰腺癌的新发和死亡增长比例将达到88.8%。2022年中国预计新发/死亡超12万人。发病率占整体肿瘤发病率排行榜第8位,死亡率占第6位。是较为凶险的癌种,有“癌王”之称。与其他癌种相比,92%的胰腺癌患者都具有KRAS突变,与多种下游免疫抑制的效应途径有关,包括:MDSC、PD-L1。除了胰腺癌本身具有的免疫逃逸固有特性之外,胰腺癌的高度免疫抑制微环境,如高比例的CD47、VEGF等免疫抑制因子的高表达,进一步导致胰腺癌的药物研发进展是十分缓慢的。特别是近年来,在诸多实体瘤领域有突破的肿瘤免疫治疗手段,在胰腺癌领域进展缓慢。包括免疫检查点抑制剂、CAR-T、肿瘤疫苗、免疫激动剂等。
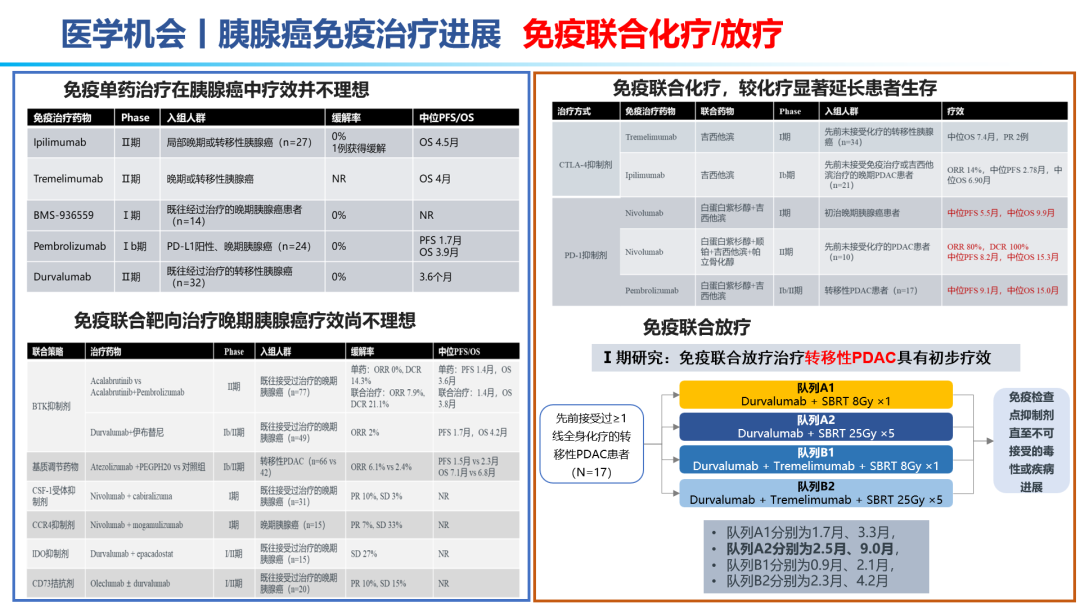
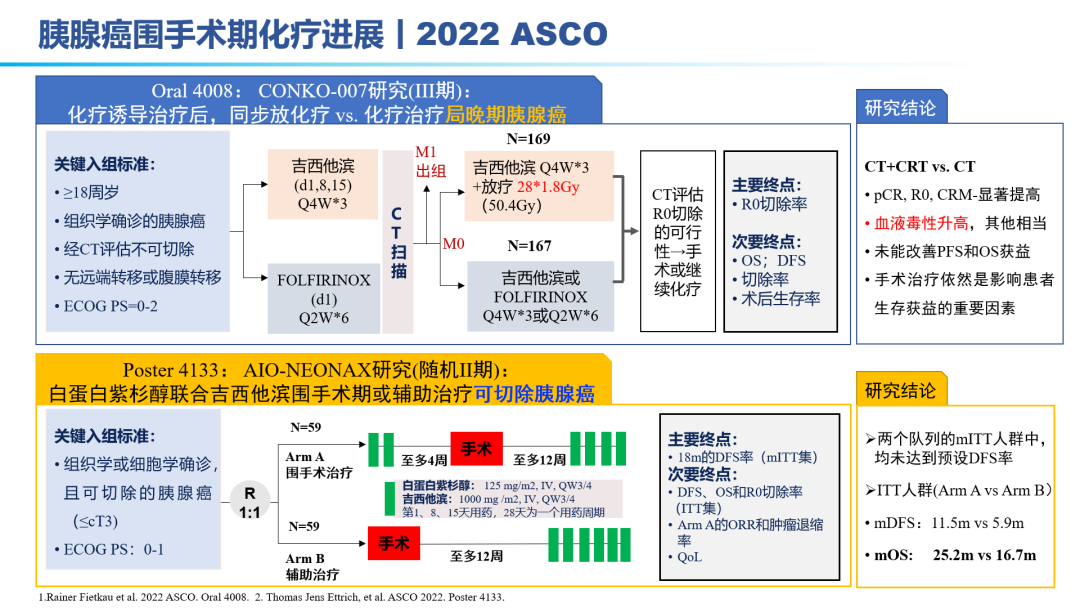
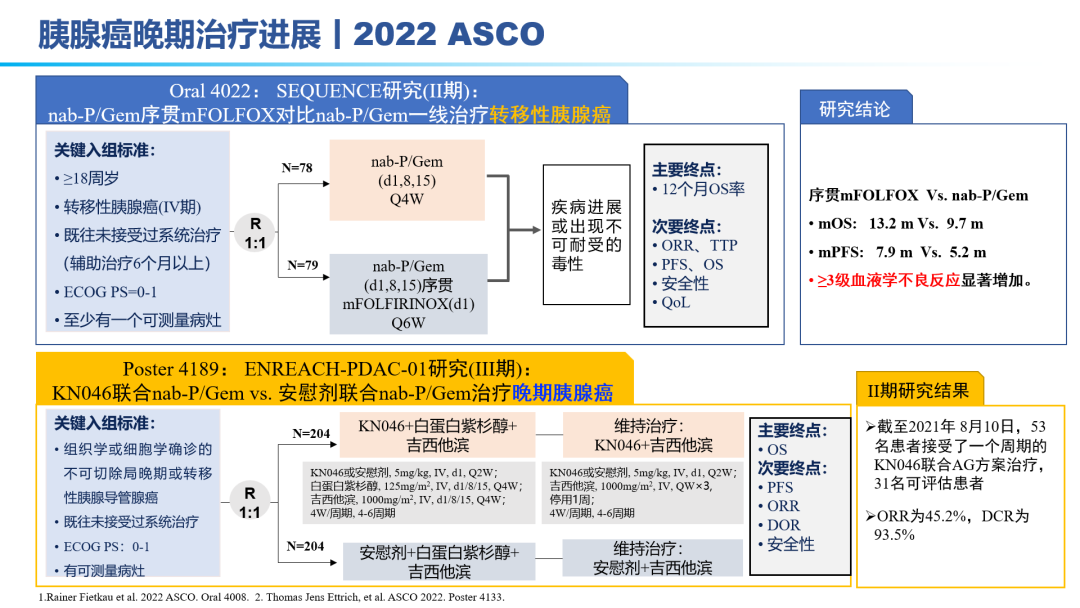
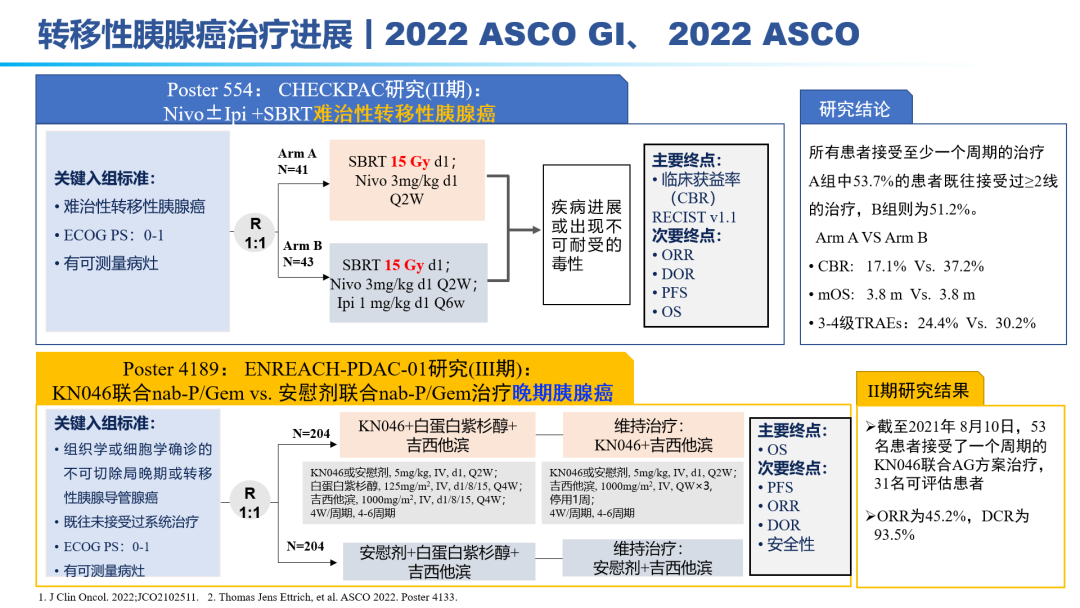
因此,胰腺癌的治疗,目前还是以化疗为主:吉西他滨联合白蛋白紫杉醇、FOLFIRINOX方案。但晚期胰腺癌患者化疗的反应率较低,不足10%,总体5年生存率仅5%~10%,即使在早期切除患者,一年内70%的患者都会进展为转移性胰腺癌,亟待更为有效治疗手段的出现。免疫单药、免疫联合靶向效果甚微,免疫联合化疗在晚期胰腺癌领域相较于化疗,效果提升显著;免疫(D±T)联合SBRT(立体定向放疗)在转移性胰腺癌患者初步效果显著。KN046联合标准化疗方案在晚期胰腺癌一线已经布局III期研究,II期研究表明,31名可评估患者:ORR为45.2%,DCR为93.5%。因此,免疫联合化疗±SBRT的多途径治疗方案 ,有望成为胰腺癌治疗的新标准。手术切除是胰腺癌患者获得治愈机会和长期生存的唯一有效方法。外科手术尽力实施根治性切除(R0)。外科切缘采用1mm原则判断R0/R1切除标准,即距离切缘1mm以上无肿瘤为R0切除,否则为R1切除。为有效提升胰腺癌患者的5年生存率,完成健康中国2030发展规划纲要,如何有效实现胰腺癌的手术切除率,成为研究热点。主要途径包括:临界可切除胰腺癌(0.6万人,5%)的新辅助治疗、局部进展期胰腺癌(4.2万人,35%)的转化治疗。肿瘤可能切除的患者获得R0切除率较低,最佳治疗策略一直存在争议。2022年ASCO大会上也相继公布了围术期胰腺癌的治疗研究进展。结合相关指南推荐:目前提倡新辅助治疗先行的治疗模式,即多学科讨论有可能获益患者考虑新辅助治疗(化疗,或者放化疗,或者诱导化疗后同期放化疗等),评估达到肿瘤降期,再行手术治疗。对于新辅助治疗后序贯肿瘤切除的患者,联合静脉切除如能达到R0根治,则患者的生存获益与可切除患者相当。联合动脉切除对患者预后的改善存在争论,尚需前瞻性大样本的数据评价。对临界可切除胰腺癌患者推荐参加临床研究。如患者本人要求,亦可直接进行手术探查。不推荐这部分患者行姑息性R2切除,特殊情况如止血挽救生命除外。辅助化疗方案推荐以吉西他滨或氟尿嘧啶类药物(5-FU、卡培他滨或替吉奥)为基础的治疗;体能状态良好的病人,建议联合化疗,包括吉西他滨+卡培他滨、mFOLFIRINOX等。辅助化疗起始时间尽可能控制在术后12周内,持续时间为6个月。对于转化治疗失败及就诊时已处于转移性胰腺癌的患者,则需要行系统药物治疗。2022 ASCO大会上也公布了化疗方案、SBRT联合免疫、双抗等手段治疗转移性胰腺癌的数据结果。对于胰腺癌的治疗,尤其是转移性胰腺癌,必然进入多学科、多种治疗手段联合应用的时代。PDAC发病率的上升和持续5年的令人沮丧的OS试验结果,凸显了对新的有效系统治疗的需要。免疫治疗在诸多实体肿瘤中显示出显著的优势,但在PDAC的治疗中迄今为止一直令人失望。已有几项有希望的临床前研究,但将其转化为临床研究具有挑战性。这与PDAC固有的免疫抑制特性和TME的复杂性紧密相关。值得肯定的是,许多正在进行的临床试验正在评估组合疗法的可行性。我们相信,通过临床医生、科学家以及最重要的患者参与的多学科方法,免疫治疗将在未来的PDAC治疗中发挥关键作用。 版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。







发表评论
注册或登后即可发表评论
登录注册
全部评论(0)