财报季刚过,辉瑞2022上半年新冠疫苗Comirnaty销售额达到220亿美元,全年预期320亿。就是这样一个世纪大品种,它的研发仅用了9个月。在药企、疫苗企业研发/生产部门工作过的朋友肯定都知道,正常情况下,这个速度不能说有多难,应该说是几乎是不可能的。那么辉瑞是如何做到的呢?
今年3月,辉瑞CEO Albert Bourla出版了一本自传书(如下图),讲述了公司在Comirnaty研发过程中的各个环节,如何通过“创新”逆转困境,将不可能改变为可能。读完之后你会发现“创新”并不仅限于发现了一个新的靶点,用了一种新的modality,探索出了新的适应症。创新的本质是一种针对问题解决问题,属于Engineering的思维模式。新药研发的道路上或许会遇到很多重复的,前人已经踩过坑的问题,但如果想要站在科技的最前沿,又怎么可能少得了那些见都没见过的难题呢?那么,什么样的企业能够在面临新冠这种百年难得一遇的全球危机中抓住机会?从这本书中,机宝学习到以下非常重要的4点:1)遇到新的问题有能力针对其量身定制一套解决方案,且方案中的每个环节都要考虑如何突破当前效率的上限;2)管理层需睿智、坚定的决策力+团队高效精准的执行力;下面机宝摘出来书中比较重要的一些信息来跟大家掰扯掰扯。由于文章太长,分两部分跟大家分享,今天先讲Part1。
天时地利人和
不得不说,辉瑞能以光速研发出新冠mRNA疫苗,天时、地利、人和三样缺一不可。用英文讲,这就叫做:Right Time,Right Place,Right People。辉瑞在新冠疫情爆发之前就已经和BioNTech有合作,研发流感、RSV疫苗,特别是针对RSV的研究让公司提前对“S蛋白”有了一定的认知。而疫情爆发就像是老天给了他们一个机会来验证mRNA技术。并且,从现在仅有的一些数据来看,新冠似乎比流感更适合用mRNA技术,就像瞎猫碰上死耗子,一来就砸中一个适配度非常高的病毒。此外,辉瑞自己本来就有一个完整的疫苗业务板块,从早期开发、临床设计、生产、到销售都是熟门熟路。首先,2020年美国本土疫情有多严重就不用我多说了。疫情越严重,3期临床就越容易做。并且在美国本地做临床,招募志愿者方便又快捷。再加上辉瑞本就是全球最大的跨国药企,所以在各个国家地区,不管是做临床(疫情爆发前,公司在全球就已经布局了100多个临床中心),还是原料的采购,或是上市后的销售都已有成熟的布局。这一点是最重要也是最复杂的,所以一两句话还真说不清楚。人的决策、创新,以及人与人之间的协作是成就这款疫苗的关键。每个环节都至关重要,比如:项目启动后到底要用哪种modality、是优先做药还是做疫苗、研发过程中如何加速加速再加速、获批后产品的分发,公司与各国政府在订单上的协调、与产业链上各种企业的合作(这一点是辉瑞CEO觉得最重要的)。整个过程中来自“人”的阻力和助力都不少。
辉瑞CEO Albert Bourla
Albert Bourla是希腊犹太人,美国籍,出生于1961年,于1993年加入辉瑞,2018年继任CEO。加入辉瑞前他是一名动物医生。Bourla继任CEO之后,最重要的事情就是公司改革,从重销售改为重研发,同时给公司做瘦身,以及启用数字化技术,并制定了6% CAGR的计划。其实早在2016年,Bourla还是辉瑞创新健康部门的负责人时,他就将研发部门进行了一系列的重组。将部门分成6个业务部门:疫苗、免疫、肿瘤、罕见病、内科、消费。每个部门的运作相对独立,自主权和自由度高,更像是一个单独的Biotech企业。而Bourla的职责就像是一个持有他们股权的PE公司。作为PE,他需要做3件事:3)资本分配/拨款,6个部门多少有点竞争关系,谁的项目更好,得到的资金支持就更多。另外,他还将管理层级以3~4:1的比例压缩,以此提升组内信息传递以及决策执行的效率。疫情在美国爆发的初期,Bourla正在欧洲出差,回程的飞机上他整理好应对疫情的思路,并写下了辉瑞当前最重要的3件事:2)保证疫情期间医院药品的供应,特别是院内注射制剂(据说当时估算的需求量是正常时期的10~15x);2020年3月2号,川普召集了各大MNC药企领导来白宫讨论应对疫情的策略。会上讨论的重点是搞药还是搞疫苗,当时的大致结论是:重点搞药!要知道药和疫苗不一样的地方是,疫苗得照着新冠这个“新病毒”重新量身定制,而药是从现成的化合物库里面筛选出来的,加上不少公司(包括辉瑞)曾今都为SARS和MERS研发过药物,分子库里说不定都有现成的候选品种。再加上当时并不确定疫情会如何演变,药只需要给生病的人吃,而疫苗理论上是要给所有人打,两者成本规模不是一个量级的。所以听起来似乎先做药确实比较合理。
但是Bourla不这么认为,从他担任CEO以来就一直在公司原有的疫苗业务基础上继续加大研发投入。因为疫苗是性价比最高的维系全人类健康的选择。所以公司决定两条腿走路,药和疫苗都要做,但是优先做疫苗。有时候选择多了也不是好事,万一选错了呢?与Moderna不一样的是,辉瑞可以选的技术路径太多了,除了mRNA,还有病毒载体、重组、佐剂、其他。对于大药企来说,通常会选择自己熟悉并且风险低的技术。比如辉瑞本来就有完整的佐剂疫苗(13价肺炎Prevnar)研发生产体系。所以按常理出牌的话,他们应该会选择这些传统疫苗的技术路径。
1)从生产技术层面讲,mRNA具备灵活性和时效性。换句话说,序列设计只需要几周时间,重组蛋白可能需要几个月。而且,只要设备到位,RNA的生产相对蛋白更简单。另外,遇上变异可以快速调整疫苗序列,随时开发新的加强针(辉瑞的Omicron BA4/5上市申请已经不需要大3期试验了)。2)从生物学层面讲,mRNA疫苗产生的细胞免疫和体液/抗体免疫都不错,重组可能细胞免疫会差一点。
3)安全性,通常疫苗专家比药物研发人员要保守很多。因为药物是给病人用的,疗效>安全性,而疫苗是给健康人用的,安全性>疗效。在这种情况下疫苗专家都大力推荐mRNA,说明安全性还是有保障的。众所周知,大多MNC的CEO都是职业经理人,换句话说公司并不是完全属于他/她一人的。通常对上市公司CEO最直接的考核标准就是股价,而最直接反映股价的就是业绩。要知道Bourla在2018年才刚接任CEO,上任不到2年正是对他业绩考核最关键的时期。在这种情况下让整个公司去重金投资于一个还没有验证过的mRNA技术at risk,最终结果打水漂的可能性极大。不止利润会下滑,连未来的收入预期也可能不达标,可想而知股价也会随之跳水。而Bourla还是坚定重金押注mRNA,其逻辑为:“在非常时期,如果辉瑞miss了业绩,过一两个季度大家也就忘了这事。但如果mRNA成了,辉瑞将会拯救世界,大家会永远记得我们!”临床1期得出的结论是有两个候选品种b1(RBD)和b2(全长S)效果比较好,但公司只能选择一个进2/3期。1)b1组临床试验做得更久,累积的数据更多更全,大约80%的数据都是来自b1的;2)b1的片段比b2小,生产起来更容易,用同样多的原料可以生产出更多的疫苗,供应量大;由于一时难以取舍,Bourla决定再多观察一个星期的数据。据说这是整个新冠疫苗项目中第一次,也是唯一一次“延期”。一周之后,团队整理所有的pros and cons,最终达成一致,选择全长S蛋白b2推进2/3期,又押中了!试想如果当时真的选了RBD,后面的3期可能数据会很好(说实话比b2也好不到哪去了,b2都接近96%了),但是过几个月、几年后可能根本挡不住delta和omicron。那就可能需要回到最初的3期重新做实验,那时可能全球大部分人都已接种过疫苗了。
不知道大家是否还记得辉瑞首次公布疫苗保护率时,只用了“大于90%”这个模糊的范围,其实当时实际的数字是95.6%(Moderna首次披露的保护率是94.6%)。但毕竟这只是interim中期数据,后面完整的数据可能会有差距,政府担心不明真相的群众会搞不清楚什么状况,所以要求他们暂时不公告具体数据,只说成功还是没成功,并承诺也会同样要求Moderna。由于数据实在太振奋人心,笼罩在疫情阴影下的人们需要这样的新闻来提升信心。所以经过再三商讨,最终OWS(Operation Wrap Seed)答应让辉瑞以“大于90%”的形式披露数据。简单来说就是:辉瑞单方面承担所有研发、生产的费用,以及研发失败所带来利润损失;如果研发成功,两家利润5:5分。前提条件是,因为时间紧迫,正式合约签订需要1个多月,所以BioNTech需要在口头协议达成之后就立刻行动。
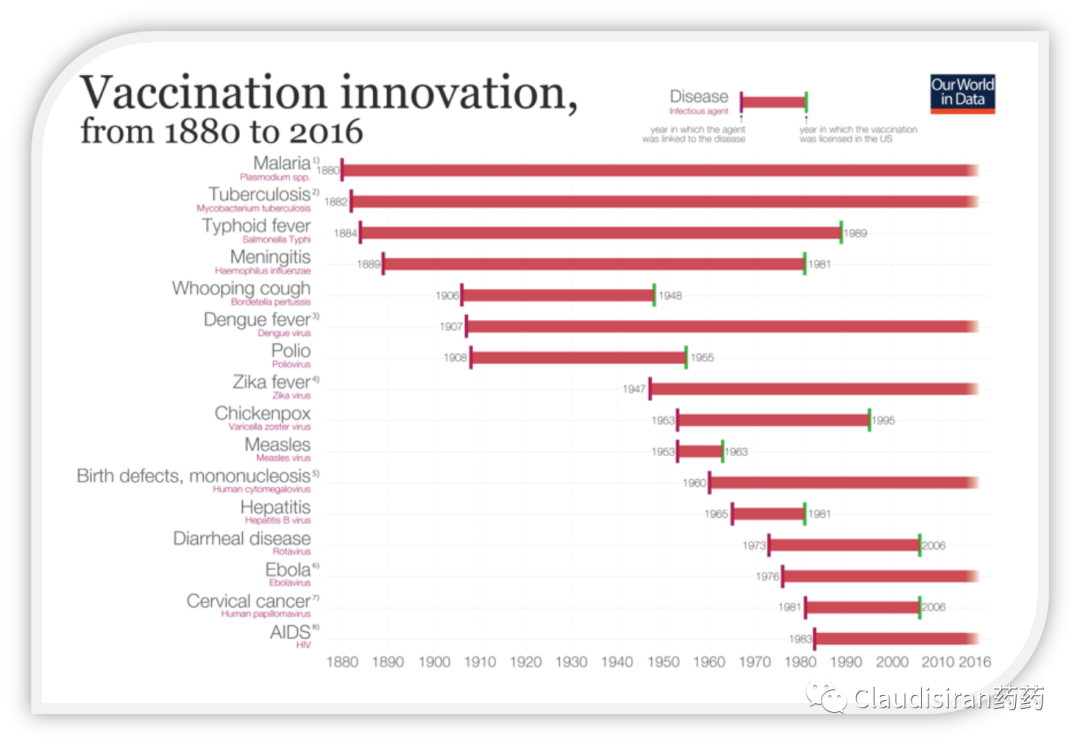
相信大家对下面这个图都不陌生,通常疫苗研发短则十年,长则几十年。即便是在科技非常发达的2020年也不可能在一年之内开发出一款疫苗,且上市销售。辉瑞研发团队最初制定的方案大约可以将整个研发周期缩短到18个月(截止3期临床数据读出),也就是2021H2的样子。随后的生产周期大约也是18个月。之所以生产需要这么长的时间,是因为当时全球都没有大规模生产mRNA疫苗的设备。所有的生产元素,包括原料(供应商)、生产设备(及设备的设计)都要从0开始。最初公司规划的是千万级别的产能。但是由于考虑到1918年的流感,第二波疫情比第一波来得更猛,叠加秋冬季可能会遇上流感+新冠双重打击,公司决定将初步产能制定为亿级。也就是说初步计划中,研发+生产合计需要3年时间,即2023年才有疫苗可以打,但这速度已经可以打破所有的历史纪录了。2023年还是太慢了。但是为保证疫苗效果和质量,临床试验、生产步骤肯定丝毫都不能省略。所以如果不能压缩每一步的时间,那就采取“平行执行”的策略。比如多个疫苗候选品种同时做临床,临床试验和生产准备同时进行,at risk扩大采购现货同时锁定预购。这无疑会带来更大的花费,但毕竟是特殊时期,花费并不是公司优先考虑的事项。这套计划可以将时间压缩至9个月,那么3期数据便可以在2020年的10月左右读出。如果一个项目在进入临床1期前有好几个类似的候选品种,通常是需要对这些品种进行横向对比、评估,然后与安慰剂对比找出最好的那个。但在时间紧迫的情况下,辉瑞决定不等所有的候选品种都齐全了再开始试验,而是谁先准备好就先上,等第二个准备好了就直接和第一个的数据做对比。其目的是快速淘汰不理想的品种(ie.第二个优于第一个,那就淘汰第一个),最后确定两个最好的(b1和b2)。所以才会出现PART1所说的b1的数据比b2多的情况。4个候选品种同时进1期平行跑实验:两个modRNA,一个uRNA,一个saRNA,其中两个是RBD,另外两个是全长S蛋白。非疫情的情况下通常是需要依次做试验的,大约会用1年的时间,而平行试验则只花了1个月时间完成1期。
在研发团队设计1/2期试验的时候生产团队就已经开始做准备了。此时没有人能确定最后用来提交上市申请的到底是哪个候选品种,所以公司需要提前预订所有候选品种的原料。因此避免不了一些浪费。对于一个从来没见过的病毒,疫苗的有效性到底该设为多少呢?FDA最初设定的下限是50%,辉瑞内部设定为60%,需要164例感染。如果做一个1~1.5万人的3期,大概1年内能出数据。样本量越大出数据的时间就越快,所以后来改到3万,然后又改成4.6万。这种规模的研究需要大约40~60个临床中心,而公司为了进一步提高招募速度,决定搞120个,最后实际搞了153个。生产车间有专门成体系的crisis management protocol(危机管理程序),分级别启动。所以即便在疫情最严重的时候,出勤率都在97%以上,保证了公司对医院的药品供应。疫苗的3期临床需要一个“稳定且高发”的病毒流行环境,才能明确证实疫苗的效果。但事实上,疫情又怎么可能一直保持稳定呢?现实中,一旦某个地区疫情爆发了,政府会干预,群众会提高警惕,经过一段时间的控制就会缓和;而一旦疫情下去了,大家会放松警惕,疫情可能又会卷土重来。所以疫情的严重程度是一个动态指标,而且人为的干预也会影响试验结果。辉瑞的流行病学专家为此专门开发了一个algorithm,可以预测各个地区疫情严重程度。比如A区疫情可能会在N周后爆发,那临床团队就会在N-4周去当地给受试者接种,N周后A区疫情爆发,正好是第二针打完的第14天,疫苗产生的免疫力刚好成熟,这时去对比疫苗和安慰剂的效果差是最合适的(21天可能更好)。由于新冠全球爆发,需各国普遍都对疫苗有高需求,并非像昂贵的肿瘤药那样以欧美地区为主战场。所以除白人以外的人种在临床试验中必定需要占据比平时更大比重。在这方面行业平均水平一直不是很理想,比如美国黑人占比13%,但临床试验的平均占比只有5%;占总人口19%的拉丁人,临床中只占1%。而辉瑞在这方面一直做的比较好,少数人种临床占比一直远高于行业平均水平,比如黑人占14.3%,拉丁占15.9%。
1)时间紧迫,第一批开发出来的疫苗暂时不考虑提升稳定性,用超低温包装运输。2)后面迭代升级的疫苗再想办法解决常温稳定性的问题。虽然疫苗还没有进入临床的时候并不知道哪个候选品种最好,所有的扩大生产都是at risk。但有一点可以确定,就是初代mRNA疫苗肯定需要超低温~-70C配送。所以配送装置可以先设计起来。
3)需要搭配大量的干冰,据估算,可能需要用掉美国所有供应量的2%,不过还好辉瑞有自己的干冰产能。
2)温度计:实时监控是否温控出问题(温度不对可能整箱产品损坏/mRNA降解);
3)光感“开箱信号”:如果箱子被打开了,辉瑞的物流中心会第一时间得知箱子是在何时何地被打开的,是否与其配送目的地吻合。
这样公司就不再依赖流通公司获取运输信息,同时也可以清楚的记录运输当地的气候、政治、社会等因素带来的运输障碍和风险。然后决定是否需要重新调整路线和物流。如果运输过程中进度严重延迟,公司则会另选一条路径快速补运。所有的数据都会通过AI持续反馈并优化下一次的配送计划。据说这个装置帮助辉瑞达到了99.9%的运输准确率。临床前设计出来的疫苗如果不能放大生产,便毫无意义。事实上在医药行业,因为无法将产能提升至商业化级别而被企业放弃的分子非常常见(比如化学合成的步骤太多,太费钱等等)。其中还有不少是在临床前各项数据非常亮眼的品种。Vertex的创始人Boger曾经说过,我们并不需要在prototype的基础上设计一个疗效好很多倍,但是特别难生产的,而是应该找一个疗效比较好,且生产比较容易的(成本低)品种。在新冠疫情爆发之前,辉瑞花了十年的时间把疫苗产能提升到每年2亿剂(大部分是Prevnar13)。新冠疫苗项目刚开始时,公司计划用9个月把产能提升1倍,结果后面发现计划4亿剂还是天真了,得继续扩。产能饱和了,还可以通过减少损耗来增加每瓶提取量。每一个超低温运送箱大约能装5*195瓶疫苗;每一瓶的量大约可以给6个人接种,所以一箱~5850剂。但公司提交的EUA是1瓶兑5剂。
这是因为每一次提取,针头上都会额外带出来一些液体,有的液体还会残留在瓶壁上无法提取,叫做"dead volume"。所以装瓶的时候就预留了一个误差空间,造成了40%的浪费。
每一瓶经过稀释的疫苗大约有2.25ml,每一剂疫苗需要约0.3ml,所以实际上一瓶疫苗中只有1.5ml是真的注射到体内的。多余的0.75就浪费掉了。所以如果能把这些“损耗”降低,那就可以从每瓶中提取6剂疫苗。公司首先想到的方法是找到合适的针头(书中虽然没有讲,但我觉得可能是和针头大小、材质,亲水性什么的有关)。合适的针找到了,新的问题又来了,这么特殊的针产能自然是不够的。因此公司决定再次承担风险,提前支付生产商,并承诺会买下所有未来卖不掉的针。随着各国接种技术的提升,有不少国家甚至可以从一瓶中提取7剂疫苗(0.3*7=2.1ml<2.25ml)。据辉瑞估算,现在全球平均每瓶接种量可达6.6剂。根据公司自己的“价值定价”模型估算,如果疫苗的保护率在65%,则可为医疗系统节省大约千亿美元的费用,那么1剂疫苗的定价应为600美元左右,确实不是很现实。如果参考现在其他技术路径比较先进的疫苗呢?例如带状疱疹,肺炎等等,售价大约是150~200美元,还是太贵!过去20年美国药企由于从病人身上赚着超高的利润,使它们的名声在各行各业处于垫底的位置。所以公司决定用新冠疫苗挽回名声,再次压价,就参考现在市面上最便宜的疫苗。流感疫苗,最贵的70美元,保护率只有50%,价格最低的20多美元。20美元这个价格够低了,但是还有下降的空间。公司决定按照世界银行的贫富标准划分3个层次的价位:3)中低收入国家+低收入国家:成本价卖给政府,但政府必须免费给国民接种。
其他科普
DMC=data monitoring comittee:第三方中立机构,只有他们可以在临床试验中最先揭盲分析数据。一般会根据数据做出以下3种决定:1)continue the study:对照组和实验组的数据差别不是很大,难下结论,所以继续做实验,看看更多患者入组,或者用药时间更长是否可以拉开差距;2)stop the study for futility:基于现有的数据可以确定两组基本上没什么差别,试验失败,没有必要继续了;3)stop the study for efficacy:基于现有的数据足以证明实验组的疗效优于对照组,且安全性可靠,所以试验再做下去对于对照组没有用药的患者是不道德的,试验成功,可以终止试验。 版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。












发表评论
注册或登后即可发表评论
登录注册
全部评论(0)