目前,肿瘤免疫与肿瘤代谢受到广泛深入的研究,国家自然科学基金委员会为进一步强化原始创新,推动肿瘤研究的原创性突破,其生命与医学板块拟资助“肿瘤免疫与肿瘤代谢”原创探索计划项目,旨在资助聚焦于肿瘤新的免疫检查点、肿瘤代谢干预新靶点的发现,以及肿瘤预防和肿瘤治疗新策略的探索项目,促进对肿瘤发生发展规律的变革性认识,实现有效预防和治疗肿瘤的目的。为此,我在这里通过《癌症中的多胺:整合机体代谢和抗肿瘤免疫》1综述为大家介绍几个实用的科研思路。长期以来,多胺代谢与癌基因有直接联系,所以多胺代谢一直是癌症治疗药物的潜在靶点。虽然大家已经广泛研究多胺调节剂对肿瘤细胞的作用,但对肿瘤微环境(TME)的非肿瘤细胞的影响知之甚少。已经有证据表明:多胺具有抗炎、免疫抑制等特性,降低多胺水平可以提高抗肿瘤免疫反应。作者在这里探讨了实体瘤中多胺的代谢变化,多胺代谢失调会影响TME中不同类型细胞的招募和功能,特别是免疫细胞。作者也讨论肿瘤微环境(低氧、炎症等)对多胺稳态的影响。最后,作者探讨多胺阻断疗法(polyamine-blocking therapies ,PBTs)在调节异常多胺代谢以及减少TME免疫抑制性的潜力。多胺代谢的致癌机制:多胺参与各种细胞过程,包括染色质组织、基因调控、细胞增殖和分化、细胞死亡和免疫系统功能。多胺的动态平衡是一个严格调控的过程,这一过程是由多胺的生物合成、分解代谢和运输之间共同调控的。癌细胞需要持续升高的细胞内多胺池来维持增殖。高水平的多胺池是通过增加生物合成、增加运输和减少分解代谢来维持的,许多癌基因(MYC、JUN、FOS、KRAS和BRAF)参与了这一过程。最值得注意的是,编码多胺生物合成的两个限速酶的基因,鸟氨酸脱羧酶(ODC;由ODC1编码)和S-腺苷甲硫氨酸脱羧酶(AMD1),都是MYC的直接转录靶标。腐胺是由鸟氨酸脱羧酶合成的,鸟氨酸脱羧酶是一种被α-二氟甲基鸟氨酸抑制的限速酶(DFMO)。S-腺苷蛋氨酸脱羧酶(AdoMetDC)产生亚精胺合成酶(SRM)和精胺合成酶(SRS)活性所需的氨丙基。精胺/亚精胺N1-乙酰转移酶(SSAT)乙酰化精胺或亚精胺的N1位,可以输出到胞外或被过氧化体乙酰多胺氧化酶(PAOX)氧化后反转。精胺可以被精胺氧化酶(SMOX)直接分解为亚精胺。PAOX和SMOX副产物(H2O2、3-氨基丙醛(3-AP)和3-乙酰氨基丙醛(3-AAP))可导致氧化应激。SSAT和SMOX可由多胺类似物(如N1,N11-双(乙基)去甲精胺(BENSpm))诱导。多胺转运抑制剂(PTI)可阻断多胺摄取(图1a)。TME中胞外多胺的来源:多胺在细胞外环境的也很丰富,特别是在胃肠道中,其管腔中的多胺来源于饮食、微生物区系和脱落或受损的细胞。大多数腔内多胺通过小肠近端被动地扩散到循环中,还有一些被主动运输到肠上皮细胞(IECS)。在IECS中,多胺可通过多胺代谢酶相互转化或以乙酰化多胺的形式分泌出胞外(在IEC顶膜和基底膜上通过多胺转运系统(PTS)介导)。在隐窝-绒毛轴的肠细胞中,抗酶(一种同时具有ODC活性和多胺转运的调节剂,OAZ)表达梯度降低,并且与ODC活性的反向梯度相关,表明多胺摄取的梯度相似。进入循环的多胺及其代谢物可被全身细胞利用,从而影响远处部位的肿瘤微环境(TME) (图1b)。
淋巴细胞功能:多胺与适应性免疫系统的功能(B细胞、T细胞的生成和激活)有关,又是ODC1表达的直接诱导者。因为MYC是ODC1表达的直接诱导者,在B细胞受体激活后,MYC以及多胺生物合成酶的表达增加。多胺上调可能导致B细胞的激活,也可以增加B细胞的肿瘤抗原呈递和随后的T细胞增殖来帮助抗肿瘤免疫。多胺的产生同时正常T细胞功能的重要部分。精氨酸是鸟氨酸的氨基酸前体,是T细胞激活和T细胞受体(TCR)信号传递所必需的。此外,多胺还调节T细胞分化。比如亚精胺通过FOXP3的诱导促进T细胞分化为调节性表型,从而减少整体炎症。但由于多胺在激活TCR信号和促进Treg细胞表型方面的竞争作用,多胺生物合成可能对炎症和肿瘤免疫原性的影响具有两面性。免疫抑制微环境:TME通常是免疫抑制的,这使恶性细胞能够逃避免疫监视。与非恶性肿瘤组织相比,恶性肿瘤中多胺生物合成酶的表达增加,并且精胺和亚精胺水平的升高与免疫抑制表型有关。产生免疫抑制表型的特殊细胞群需要高水平的多胺来支持其生长和代谢。髓系来源的抑制细胞、树突状细胞和单核细胞来源的M2巨噬细胞通常在肿瘤的免疫抑制微环境中大量存在,这些细胞类型都依赖于多胺代谢来发挥抑制免疫系统的功能。比如说,精氨酸通过精氨酸酶1(ARG1)转化为鸟氨酸,导致鸟氨酸脱羧酶(ODC)和多胺生物合成的上调。细胞内多胺池的增加促进了肿瘤细胞的增殖和存活。巨噬细胞极化是由精氨酸代谢介导的:通过一氧化氮合酶(NOS)将精氨酸转化为一氧化氮可促进原免疫、抗肿瘤M1表型。M1巨噬细胞释放IL-1β和TNF,促进T细胞的增殖和存活。肿瘤细胞释放的细胞因子IL-4和IL-10通过上调ARG1促进M2极化。M2巨噬细胞缺乏M1巨噬细胞产生一氧化氮的能力,或者使用上调的ARG1将精氨酸转化为鸟氨酸。因此,M2巨噬细胞与效应T细胞竞争T细胞功能所需的精氨酸和谷氨酰胺,同时产生免疫抑制细胞因子IL-4和IL-16(图2)。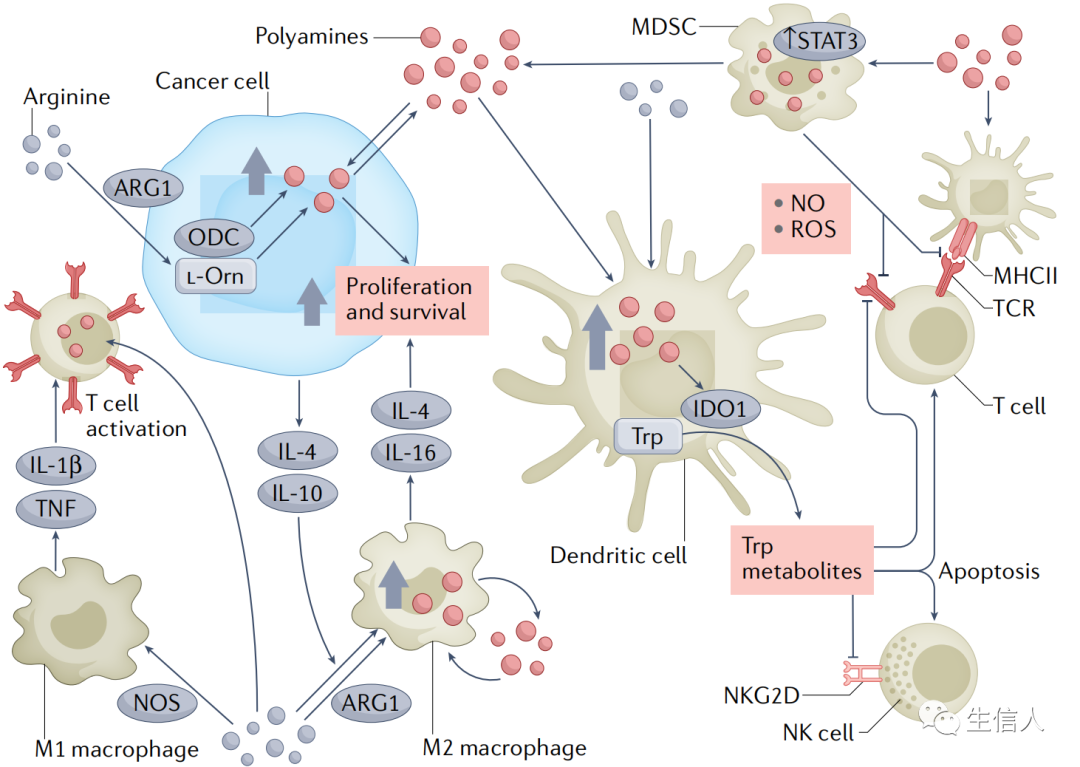
缺氧环境:缺氧性TME对肿瘤细胞多胺稳态有多方面的影响,低氧刺激多胺摄取和鸟氨酸脱羧酶(ODC)介导的多胺生物合成,显著增加肿瘤细胞腐胺和亚精胺水平。细胞外精胺使CD44细胞黏附分子(低氧诱导)表达的减少,促进肿瘤细胞的迁移、侵袭和转移。多胺分解代谢酶SSAT通过在有氧条件下稳定缺氧诱导因子1α(HIF1α)与RACK1的相互作用来调节HIF1α的降解。HIF1α还可直接刺激精胺氧化酶(SMOX)的转录,这是一种能够产生活性氧(可导致DNA损伤)的核酶和胞内酶。来自SMOX反应的丙烯醛可能会产生促炎趋化因子CXC基序配体1(CXCL1),进而促进细胞迁移,该配体被表达CXCR2的肿瘤相关中性粒细胞、髓系来源的抑制细胞和肿瘤细胞识别。SMOX受miR-124负调控,并在低氧组织中的表达减少,并与低氧基因信号负相关。炎症:炎症是支持癌症发生和发展的易感因素。暴露在炎症条件(病原体感染、物理刺激、缺氧和肠道屏障衰竭)下的上皮细胞致癌的风险增加。如上文所述,炎症调节因子可产生更利于肿瘤生长的TME,其特征是免疫抑制细胞的渗透,同时也向上皮细胞和癌细胞提供促进生长的信号。慢性感染和炎症可诱导上皮细胞多胺代谢的改变,特别是通过诱导SMOX及其产生的活性氧物种,导致DNA损伤和表观遗传学改变而导致肿瘤的发生。例如,幽门螺杆菌相关性胃癌高危患者中的SMOX靶向miR-124基因的甲基化增强。免疫和在上皮细胞炎性细胞因子(感染时产生的)的刺激下进一步促进多胺代谢。胞外多胺可以提供抗炎作用,但也有可能产生有利于转化细胞选择性生长的免疫抑制微环境。利用多胺代谢降低慢性炎症环境中表观遗传或基因变化是一个正在进行的研究领域(图3)。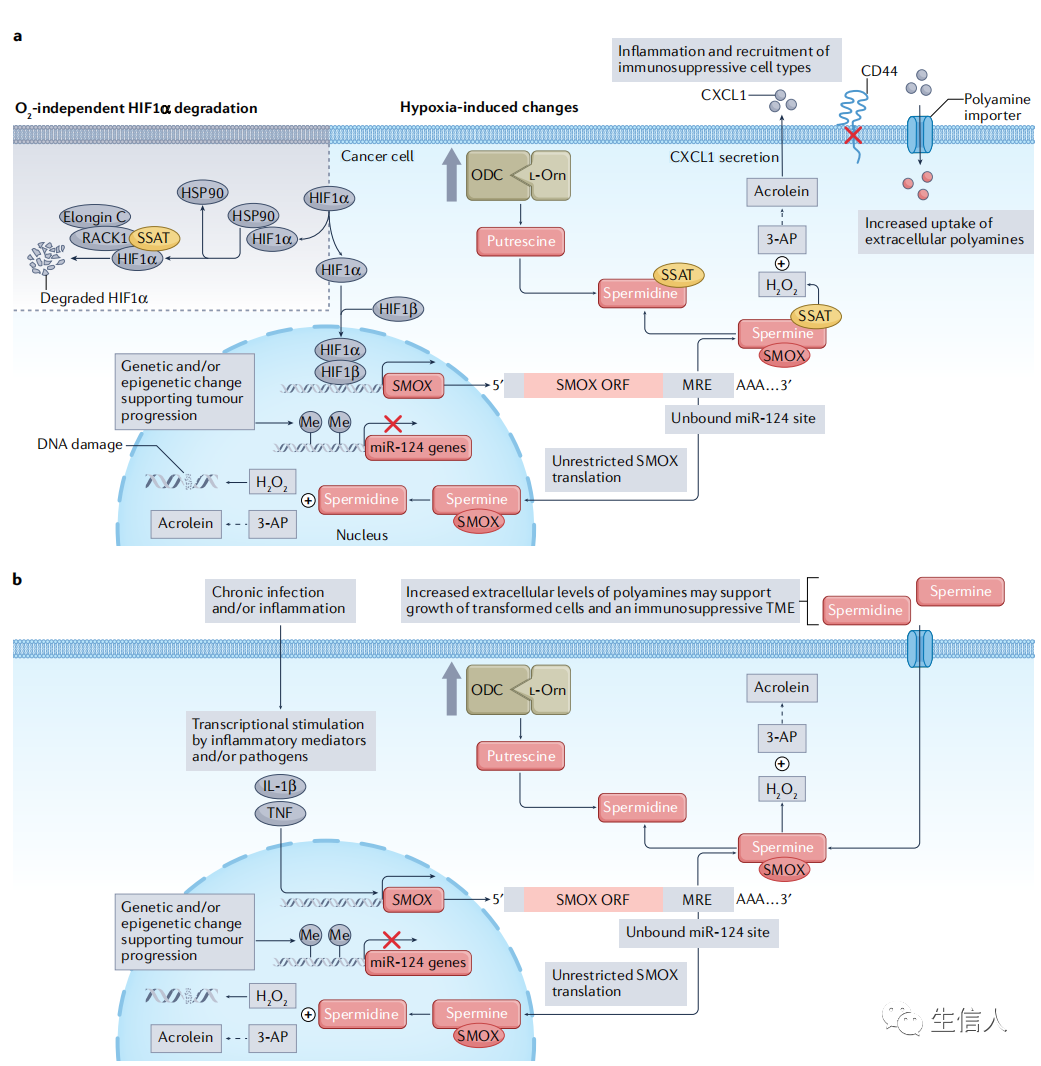
图3缺氧和慢性感染/炎症微环境促进致癌相关的多胺代谢
肿瘤细胞对多胺的依赖性以及多胺在各种免疫细胞类型中的重要生理作用使得靶向多胺代谢途径成为一种可行的治疗策略。虽然已经有很多的多胺生物合成酶抑制剂,但迄今为止最成功的抑制剂是二氟甲基鸟氨酸(DFMO)。它的细胞抑制特性已经在许多体内模型中成功地防止了肿瘤的形成,临床试验表明,低剂量的DFMO是安全的,足以降低多胺水平。近年来,免疫疗法是发展最快的抗癌疗法。虽然免疫疗法在治疗黑色素瘤、肾细胞癌和非小细胞肺癌方面取得了显著的成功,但许多实体肿瘤对免疫检查点抑制剂没有反应。许多“冷”肿瘤对多胺的高度依赖使它们成为多胺靶向治疗的有力候选者。虽然已经有无数尝试来实现冷肿瘤的免疫重编程,但通过PBTs作为免疫调节剂来降低多胺水平的策略是一个新的但迅速发展的领域。大量研究表明,降低可用多胺水平可以阻止肿瘤的增殖,同时提高冷肿瘤的免疫原性。表1列出了在PBTs中用于潜在调节TME和肿瘤细胞的化合物。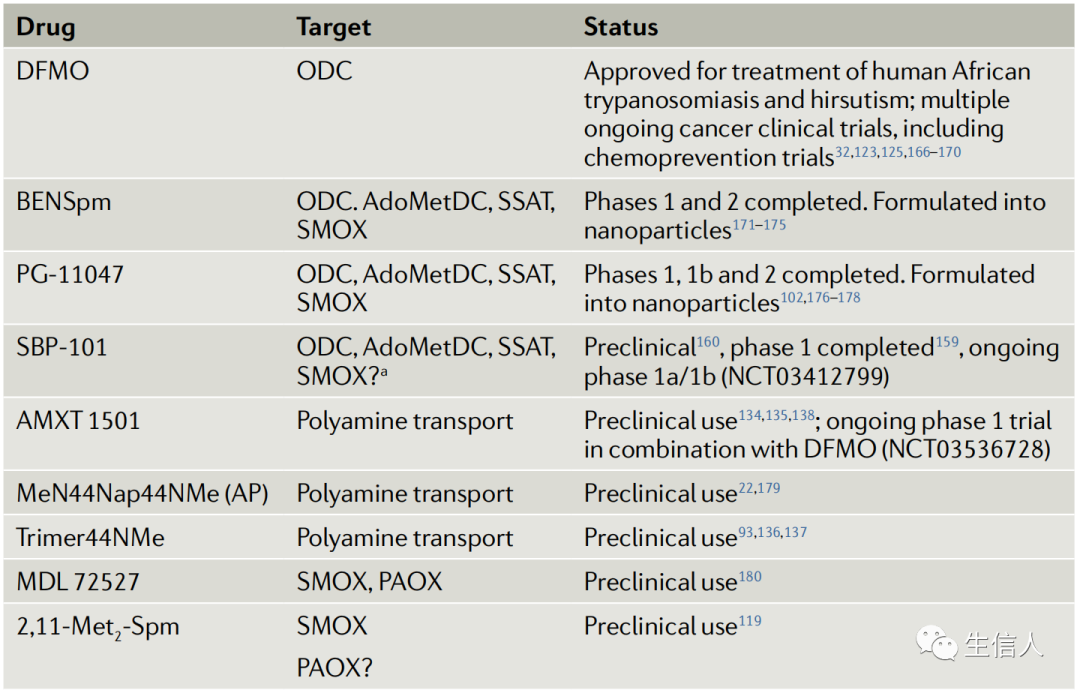
表1 正在开发中的影响多胺代谢、TME和免疫反应的化合物
肿瘤从其原发部位转移的过程与预后不良密切相关。当肿瘤细胞迁移到其他组织时,肿瘤细胞会经历各种刺激。这导致许多转移瘤与它们起源的肿瘤相比具有不同的代谢特征,使它们能够在新环境中生存和生长。但是,我们对代谢途径的改变是否影响转移的其他方面知之甚少。新出现的证据描绘了癌细胞在转移过程中特定的代谢改变,可以潜在地利用其阻止转移生长,甚至成功阻止肿瘤定植。这些改变不仅是转移性肿瘤类型内在地表现方式,而且还会动态地依赖于肿瘤转移的阶段和位置。乙醛脱氢酶1A3(ALDH1A3)是一种肿瘤干细胞(CSC)标志物,在乳腺癌中与三阴性/基底细胞样亚型和侵袭性疾病相关。在下面案例2中,作者发现大家对ALDH1A3在癌症中的作用机制的研究主要集中在该酶诱导的基因表达变化上。然而,到目前为止,还没有人研究它对代谢的影响,对其代谢的研究可能会揭示新的发病机制。作者通过结合代谢组学和转录组数据,证明GABA代谢是表达ALDH1A3的乳腺肿瘤的主要失调途径。ALDH1A3和GABA治疗均可促进肿瘤转移。患者数据集分析显示,ALDH1A3和GABA途径基因之间的表达关联,以及相应的转移风险增加。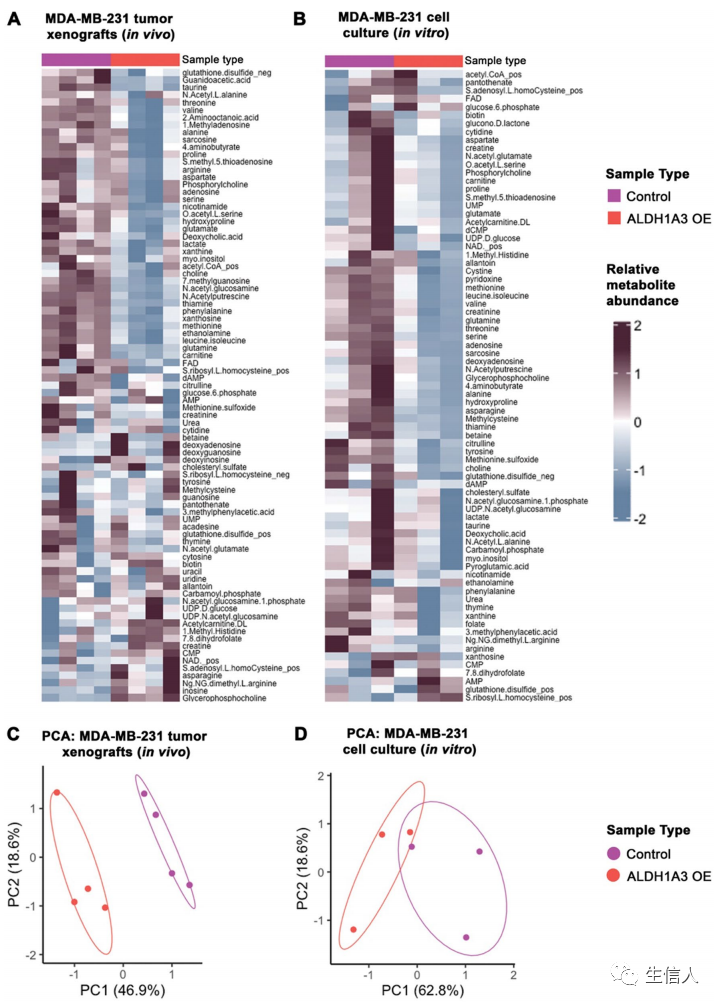
代谢组学鉴定过表达ALDH1A3的MDA-MB-231乳腺肿瘤细胞的代谢改变。
癌症相关成纤维细胞 (cancer-associated fibroblasts, 简称 CAFs) 是 TME 中的主要基质细胞,参与癌症发展的所有阶段。CAFs 通过分泌各种因子促进癌细胞生长、血管生成、上皮间质转化 (EMT)、ECM 重塑与癌细胞转移。不仅于此,CAFs 也会募集免疫抑制细胞 (包括 MDSCs 和 TAMs) 来抑制细胞毒性 T 细胞 (CTLs) 的活性,导致免疫抑制与肿瘤逃逸。甚至CAFs 还会通过促进癌症干性 (stemness)、代谢调节和干扰免疫治疗效果来促进癌症复发和耐药性。由于 CAFs 参与癌症发展的每个阶段,靶向 CAFs 成为抗癌药物开发的重点策略之一。在下面的案例中3,作者利用脂质组学方法,发现临床PM-CRC(peritoneal metastasis (PM) of colorectal cancer (CRC))标本中含有不饱和酰链的磷脂酰胆碱(PC)的丰度增加。此外,作者发现CAFs在原发PM-CRC肿瘤中存在较高的丰度,重要的是,通过非靶向代谢组学分析和脂肪酸示踪分析,作者发现CRC细胞摄取了CAFs分泌的脂质和类脂代谢产物。体外和体内实验均表明,棕榈酸钠可降低CAF引起的细胞膜流动性改变,限制糖代谢,抑制细胞侵袭,抑制肿瘤生长和腹膜转移。棕榈酸钠浓度升高可诱导与脂毒性有关的细胞凋亡。此外,棕榈酸钠在体外有效地增强了5-氟尿嘧啶(5-FU)的抗肿瘤活性,在体内耐受性良好。综上所述,这些发现表明,在新辅助化疗中加入饱和脂肪酸(S-FA) 棕榈酸钠可能为未来治疗PM-CRC开辟新的机会。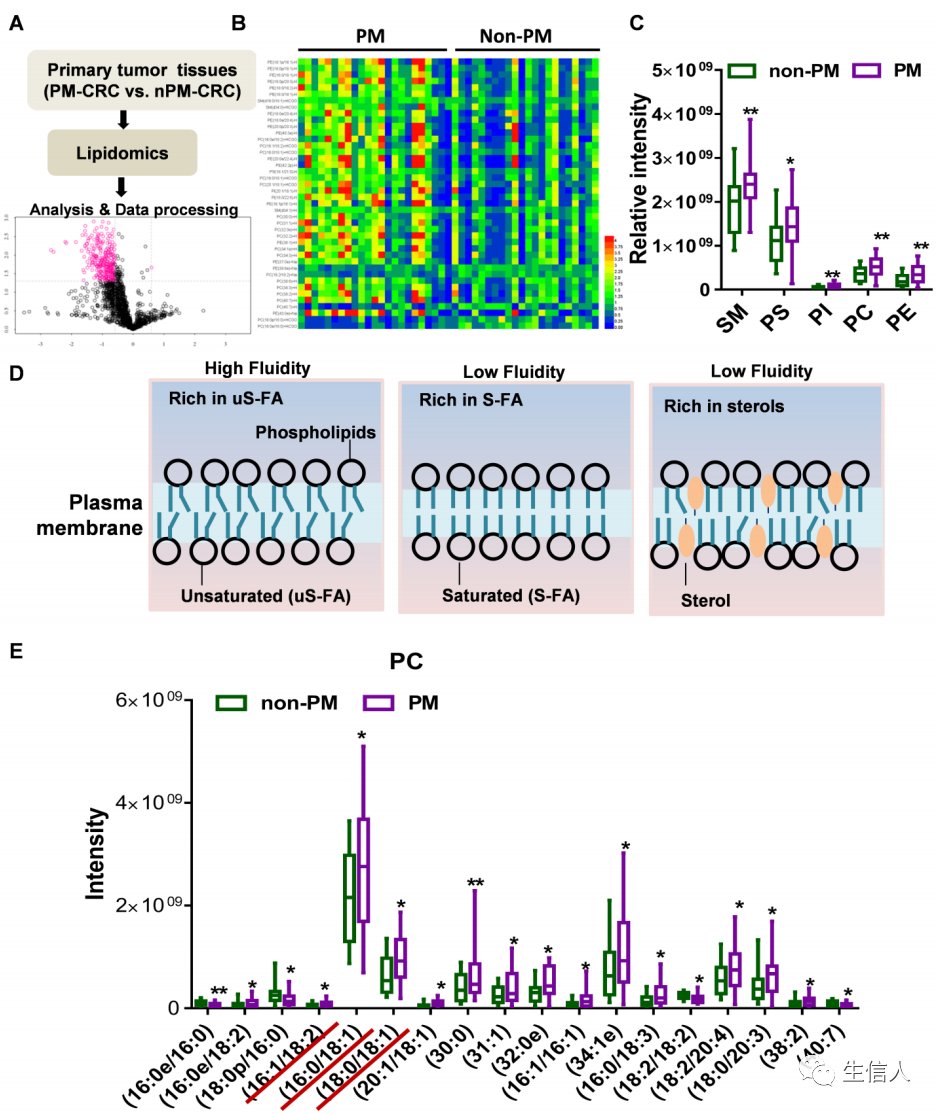
图4 脂类组学分析临床PM-CRC标本中丰度显著改变的脂类。
机体免疫系统具有免疫监视功能,当体内出现恶变细胞时,免疫系统能够识别并通过免疫机制特异地清除这些“非己”细胞,抵御肿瘤的发生发展。然而,恶变细胞在某些情况下能通过多种机制逃避机体的免疫监视,在体内迅速增殖,形成肿瘤。也就是说肿瘤细胞可通过多种机制逃避机体免疫的识别和攻击。代谢酶和代谢产物在免疫细胞信号传导中表现出非代谢功能,从而调节免疫攻击能力。但是,肿瘤的代谢重塑是否以及如何促进其免疫抵抗性尚待阐明。肿瘤免疫逃逸机制的深入研究,可以为探讨肿瘤免疫治疗提供了新思路。下面的案例中4,首先,作者对胰腺癌细胞用进行功能筛选,筛选在肿瘤中转录上调并且能够帮助肿瘤细胞免疫逃逸的代谢基因,其中MTHFD2的分数较高。之后,作者对MTHFD2的RNA序列进行GSEA基因富集分析,发现MTHFD2通过上调PD-L1表达促进肿瘤免疫逃逸。接下来,作者对野生型和MTHFD2无催化活性突变体进行代谢组学分析,筛选代谢物对PD-L1的作用, MTHFD2能够影响细胞中整体的O-GlcNAc水平。最后得出MTHFD2是通过转录因子cMYC的O-GlcNAc修饰促进PD-L1表达。总之,作者发现了叶酸循环酶MTHFD2在帮助肿瘤细胞免疫逃逸方面的作用,该蛋白可能成为未来癌症治疗的靶标之一癌症代谢重编程。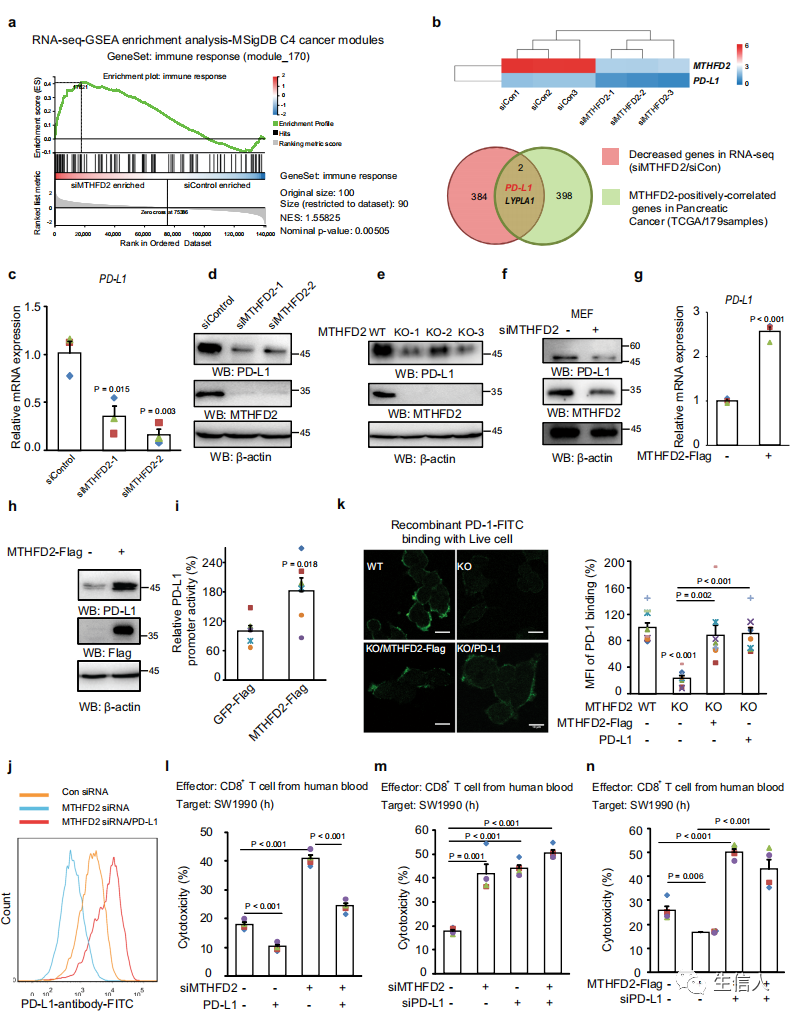
图5 MTHFD2通过上调PD-L1表达促进肿瘤免疫逃逸。
现在大家认为肿瘤代谢的重编程是各种恶性肿瘤的标志。代谢的变化不仅对肿瘤细胞有显著影响,而且对肿瘤细胞的免疫微环境也有影响。虽然免疫疗法在治疗多种实体瘤方面取得了突破性进展,但目前的肿瘤免疫治疗手段仍然存在局限性。在这里我们便可以用生信的方法系统地描述肿瘤代谢相关和免疫相关基因集的特征,展示肿瘤代谢相关和免疫相关的特征来预测肿瘤患者的预后、对免疫治疗的反应等。下文中5,作者结合不同的生物信息学和统计学方法,构建一个氨基酸代谢相关和免疫相关的风险特征,以区分预后和临床病理特征。利用基因模型构建了诺模图来增强的风险分层和量化的风险评估。作者发现诺模图在预测胶质瘤患者的总体存活率方面表现出很高的准确性。在作者的分析中,氨基酸代谢相关和免疫相关的风险特征被定义为胶质瘤患者预后的独立危险因素。此外,作者还通过GSEA分析相关的生物学机制和蛋白质-蛋白质相互作用网络识别风险特征的HUB基因。总之,作者构建了一个新的氨基酸代谢相关和免疫相关的风险特征来预测胶质瘤的预后,并确定两个新的潜在生物标志物。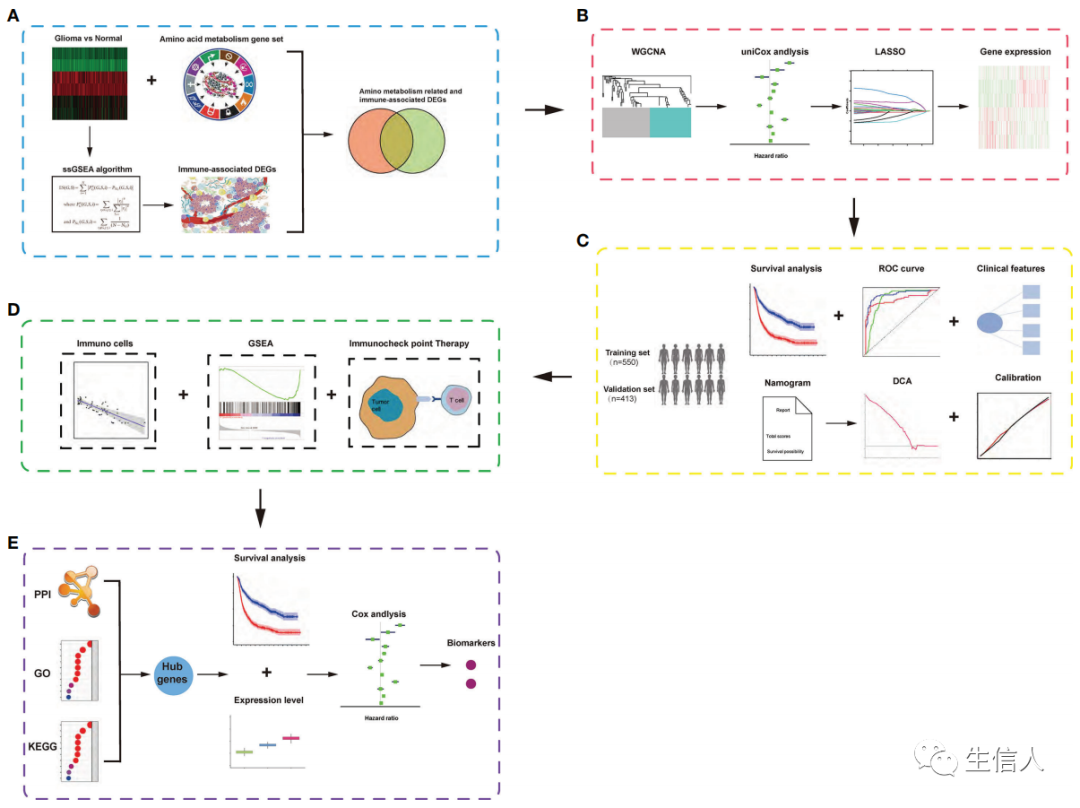
在肿瘤细胞和TME中,各种代谢机制和免疫机制调控着肿瘤细胞对代谢物的反应。肿瘤浸润环境下的免疫细胞通常由于肿瘤细胞代谢失调而承受超负荷代谢压力,导致抗肿瘤免疫反应受损。此外,肿瘤细胞经常利用免疫检测点来逃避免疫监测,这一过程也与代谢相关。从热点选择上来看,肿瘤代谢和肿瘤免疫两种热点的选择是此篇文章的亮点。所以小编在这里建议大家,巧妙的结合当下研究热点发表高分文章!
文献 ▎ 1.Holbert CE, Cullen MT, Casero RA, Jr., Stewart TM. Polyamines in cancer: integrating organismal metabolism and antitumour immunity. Nat Rev Cancer Apr 27 2022.doi:10.1038/s41568-022-00473-2.2.Dahn ML, Walsh HR, Dean CA, et al. Metabolite profiling reveals a connection between aldehyde dehydrogenase 1A3 and GABA metabolism in breast cancer metastasis. Metabolomics Jan 6 2022;18(1):9.doi:10.1007/s11306-021-01864-6.3.Peng S, Li Y, Huang M, et al. Metabolomics reveals that CAF-derived lipids promote colorectal cancer peritoneal metastasis by enhancing membrane fluidity. Int J Biol Sci 2022;18(5):1912-1932.doi:10.7150/ijbs.68484.4.Shang M, Yang H, Yang R, et al. The folate cycle enzyme MTHFD2 induces cancer immune evasion through PD-L1 up-regulation. Nat Commun Mar 29 2021;12(1):1940.doi:10.1038/s41467-021-22173-5.5. Xu Y, Ye L, Geng R, Hu P, Sun Q, Tong S, Yuan F, Chen Q. Development and Verification of the Amino Metabolism-Related and Immune-Associated Prognosis Signature in Gliomas. Front Oncol 2021;11:774332.doi:10.3389/fonc.2021.774332. 版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。














发表评论
注册或登后即可发表评论
登录注册
全部评论(0)