2022-10-27 来源 : vip说

靶向治疗期间肝功能储备的预测
(Unresectable HCC )

肝细胞癌(HCC)是全球癌症相关死亡的主要原因之一。晚期 HCC 患者亟需新的治疗选择和适当的治疗策略。
仑伐替尼、多纳菲尼已被批准作为晚期 HCC 患者的一线系统治疗。瑞戈非尼和靶向血管内皮生长因子受体 (VEGFR) 2 的雷莫芦单抗已被批准用于的二线系统治疗,雷莫卢单抗在国内也已获批。
在不可切除的 HCC 患者中,与索拉非尼治疗相比,VEGF 抑制剂贝伐单抗和阿利珠单抗(PD-L1)的联合治疗(IMbrave150)有更好的总生存期 (OS) 和无进展生存期 (PFS)。近期Leap 002研究虽未达到双终点,但仑伐联合K药已刷新晚期一线OS数据。对于不可切除的 HCC 患者,可以使用由新疗法组成的序贯疗法。然而,这些患者中的大多数都由慢性肝病(HBV、HCV、NAFLD)以及既往治疗导致的肝功能储备恶化,影响患者预后并限制治疗的选择。
仑伐替尼在无法切除的 HCC 患者中的疗效和安全性已在真实世界研究中的得到证实。然而,一些患者在仑伐替尼治疗 HCC 期间肝功能储备恶化。最近,Terashima 等人指出,在晚期 HCC 的酪氨酸激酶抑制剂 (TKI) 治疗期间维持肝功能储备有助于改善 OS 和 PFS。 然而,TKI 治疗期间肝功能储备恶化的预测指标尚未完全阐明。
近期有文献研究基线血清血管生成素(ANG-2)和血管内皮生长因子(VEGF)预测靶向治疗HCC期间的肝功能储备恶化情况。
Baseline serum angiopoietin-2 and VEGF levels predict the deterioration of the liver functional reserve during lenvatinib treatment for hepatocellular carcinoma
不可切除的肝细胞癌 (HCC) 系统治疗期间肝功能储备恶化会导致患者预后不佳。为了确定基线使用靶向药物仑伐替尼 8w后患者Child-Pugh 评分差的预测因素, 回顾性收集患者治疗的临床数据和血清样本的数据,其中血清包括基线可评估的患者成纤维细胞生长因子 (FGF)19 和 21、血管生成素 (ANG)2 和血管内皮生长因子 (VEGF) 检测数据。
研究共纳入 37 名患者,结果显示6 例CR、15例PR、14例SD和和 2例PD。24 名 (65%) 和 13 名 (35%) 患者分别表现出维持/改善和恶化的 Child-Pugh 评分。
虽然两组患者的基线数据、治疗药物等相似,但在 Child-Pugh 评分差的患者中,基线 ANG2 和 VEGF 水平分别显着更高(P = 0.0017)和更低(P = 0.0231)。根据受试者工作特征曲线分析,发现 ANG2 和 VEGF 的cut-off 值分别为 3,108 pg/mL 和 514.9 pg/mL。在低 VEGF 和高 ANG2 的患者中,89% (8/9) 的 Child-Pugh 评分恶化,而没有高 VEGF 和低 ANG2 的患者 (0/9)。接受靶向治疗药物(仑伐替尼)治疗的不可切除HCC 患者肝功能储备情况可以根据基线血清学 ANG2 和 VEGF 水平进行预测
正常肝窦微血管密度因VEGF特异性阻断而降低。肝血流量减少可能导致肝功能储备恶化;因此,研究假设基线血清生长因子VEGF、成纤维细胞生长因子(FGFs)和血管生成素(ANG),可能与TKI治疗期间肝功能储备恶化有关。因此,研究评估了不可切除的HCC患者接受仑伐替尼治疗8w后,其与肝功能储备恶化的关系。
基线数据:性别;年龄;HCC的病因学;实验室数据:AFP、凝血酶原;BCLC 分级;Child-Pugh评分;血清FGF19、FGF21、ANG2和VEGF。在使用仑伐替尼后,每两周进行一次实验室检查和体检,每2-3个月根据增强CT评估治疗反应。
定期评价治疗反应和肝功能储备的变化:肝功能储备的变化被评估为基线和治疗开始后8w之间Child-Pugh评分的变化。该研究在治疗后8w通过增强CT评估大多数患者的治疗反应,来决定继续或停止仑伐替尼。(mRECIST评估)每2-3个月评估一次仑伐替尼的治疗缓解情况。
基线血清生物标志物的分析:血清VEGF、ANG2、FGF19和FGF21检测(ELISA)。
结果:研究筛选2018年4月至2020年1月期间在北海道大学医院和相关医院接受治仑伐治疗的59例不可切除HCC患者。其中,22例患者不符合入组标准被排除在外,37名不可切除HCC患者纳入研究。

表1 患者基线特征

表2 仑伐替尼治疗HCC期间有/没有 Child-Pugh 评分恶化患者的疗效比较
仑伐替尼治疗 8 周,有或没有 Child-Pugh 评分恶化的患者的最佳治疗反应率相似(P = 0.4039),说明即使在有客观反应的患者中,也有患者出现肝功能恶化。
仑伐替尼治疗后 8w有无 Child-Pugh 评分恶化的患者特征比较
如表 2 所示,仑伐替尼治疗后 8 w,24 名(65%)患者表现出 Child-Pugh 评分维持/改善;13 名(35%)患者表现出 Child-Pugh 评分恶化。Child-Pugh 评分中最常见的指标是血清白蛋白水平。
如下图表 3 所示,两者患者组的肝病病因、性别、年龄、BCLC 分期、Child-Pugh 分级和肿瘤标志物相似
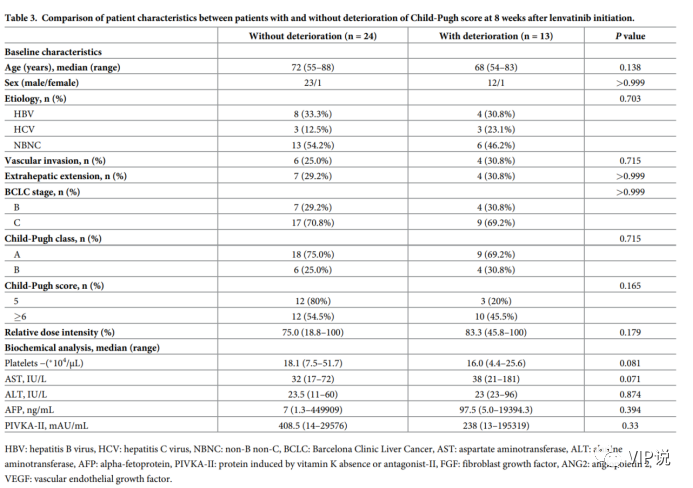
基线血清生长因子与 Child-Pugh 评分变化的关系
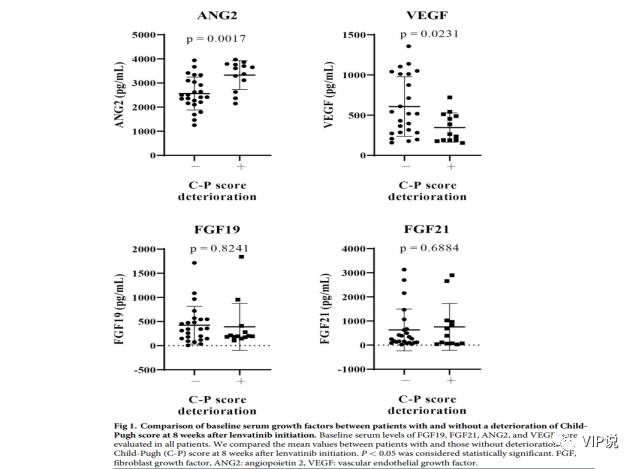
如上图 ,研究分析了基线血清水平(ANG2、VEGF、FGF19 和 FGF21)与仑伐替尼治疗后 8 w的 Child-Pugh 评分变化之间的关系。8w治疗后 Child-Pugh 评分恶化的患者相比于非恶化的患者,基线 ANG2 水平(P = 0.0017)显着高于基线,基线 VEGF 水平(P = 0.0231) 显著低于基线。
两组的基线血清 FGF19 和 FGF21 水平相似。在基线 ANG2 和 VEGF 水平之间未观察到显着相关性(r = 0.111,P = 0.514;图 2)。

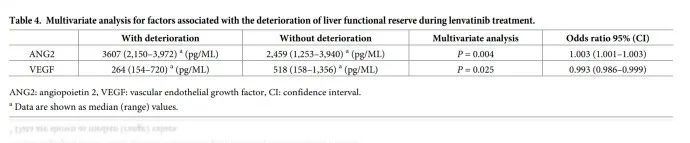
此外,多变量分析显示基线 ANG2 和 VEGF 水平是预测肝功能储备恶化的独立因素(表 4)。因此,研究提出基线ANG2 和VEGF 水平作为仑伐替尼治疗后的Child-Pugh 评分恶化的预测因子。
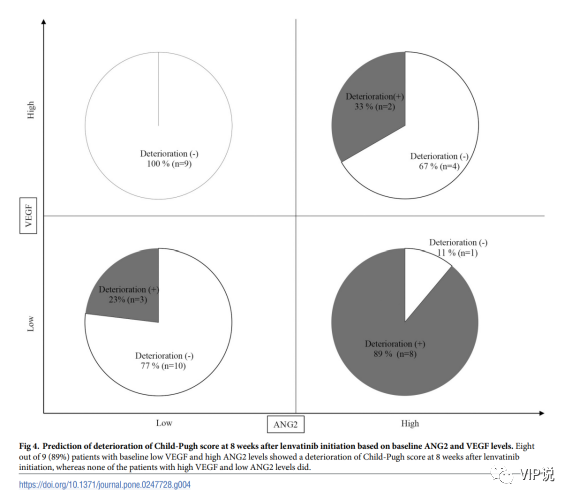
基于基线血清 ANG2 和 VEGF 水平的仑伐替尼治疗后的患者Child-Pugh 评分变化分类
由于基线高 ANG2 和低 VEGF 水平与仑伐替尼治疗 HCC 后的 Child-Pugh 评分恶化显着相关。研究进行 ROC 分析以确定具体基线 VEGF 和 ANG2 的cuto ff值与 8w治疗后 Child-Pugh 评分恶化的相关性

如上图3 所示,ANG2 和 VEGF 的临界值为 3108 pg/mL和 514.9 pg/mL ,
研究也基于基线 ANG2 和 VEGF 水平分析仑伐替尼治疗后 Child-Pugh 评分的变化。如下图4 所示, 89% (8/9) 基线低 VEGF 和高 ANG2 水平的患者显示 Child-Pugh 评分恶化,而基线高 VEGF 和低 ANG2 水平的患者则无。因此,根据 ANG2 和 VEGF 的联合水平,可预测使用仑伐替尼治疗后 HCC 的患者 Child-Pugh 评分的恶化。

阿可拉定的QOL数据显示其
推迟肝功恶化,弥补靶向治疗的不足.

肝癌是炎性、代谢等多种因素相互影响的疾病。肝功能恶化与否并不能单一通过某个基线水平数据做决定,需要综合考虑、动态观察指标的变化并及时调整治疗方案。
研究证实, ANG2通过对Tie2介导的信号传导的拮抗作用而破坏血管稳定性。因此,高ANG2水平被认为与血管渗漏和炎症有关。高血清ANG2水平与门静脉高压和肝纤维化不消退也有关,即使在通过直接抗病毒药物成功根除丙型肝炎病毒后也是如此。总的来说,这些报告和这项研究的结果表明,血清ANG2水平升高可能与通过诱导血管渗漏和炎症导致的肝功能恶化有关。
阿可拉定是小分子免疫调节剂。既往III期SNG1705 ICR-1研究证实中位至恶化时间是7.3个月。有研究证明,仑伐替尼经治患者QOL的中位至恶化时间仅有2.7个月。阿可拉定通过对肿瘤免疫微环境的调节作用及炎症通路的抑制,实现抗肿瘤的疗效,且TTP数据可以进一步说明阿可拉定可以进一步延缓肝功能恶化的发生。且阿可拉定≥3级不良反应、致永久停药的不良反应、以及与药物相关的SAE发生率均明显低于现有晚期HCC一线其他标准治疗方案,这从侧面说明其可以推迟肝功能恶化时间。
2022年CSCO指南推荐阿可拉定为晚期肝癌一线治疗药物。从阿可拉定(肝癌新希望,居然是这款药)III期SNG1705 ICR-1研究得知,淫羊藿素治疗组入组基础状态较差的患者人群。对于其他药物三期注册临床未涵盖的VP4人群也纳入其中,占比高达66.7%,中位OS不差于晚期一线标准治疗单药,达13.54个月。目前已广泛推荐用于晚期一线的联合治疗。在卓越疗效及安全性的基础上,阿可拉定可为晚期肝细胞癌患者带来生活质量的改善,延缓肝功能恶化的发生,是肝癌患者晚期一线联合治疗首选。
肝癌诊疗需要联合延缓肝功能储备恶化且疗效优越安全高的治疗药物,从而弥补联合治疗方式的不足。该研究中,低VEGF和高ANG2而导致肝窦微血管密度低,导致肝功能储备恶化。需要进一步的基础和临床研究来评估这一假设。但该研究有几个局限性;这是一项回顾性研究,纳入的患者数量相对有限。因此,需要在未来的大样本前瞻性研究中进一步验证。
参考文献
1. Mo D, et al. Eur J Immunol. 2021 Apr;51(4):978-988.
2. Llovet JM, Burroughs A, Bruix J. https://doi.org/10.1016/s0140-6736(03)14964-1
3. Cheng AL, Kang YK, Lin DY, Park JW, Kudo M, Qin S, et al. J Clin Oncol. 2013; 31(32):4067–75. https://doi.org/10.1200/JCO.2012.45.8372 PMID: 24081937.
4. Johnson PJ, Qin S, Park JW, Poon RT, Raoul JL, Philip PA, et al. J Clin Oncol. 2013; 31(28):3517–24. https://doi.org/10.1200/JCO.2012.48. 4410 PMID: 23980084.
5. Cainap C, Qin S, Huang WT, Chung IJ, Pan H, Cheng Y, et al. J Clin Oncol. 2015; 33 (2):172–9. https://doi.org/10.1200/JCO.2013.54.3298 PMID: 25488963; PubMed Central PMCID: PMC4279237.
6. Bruix J, Qin S, Merle P, Granito A, Huang YH, Bodoky G, et al. Regorafenib for patients with hepatocel- lular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double-blind, pla- cebo-controlled, phase 3 trial. Lancet. 2017; 389(10064):56–66. https://doi.org/10.1016/S0140-6736 (16)32453-9 PMID: 27932229.
7. Zhu AX, Kang YK, Yen CJ, Finn RS, Galle PR, Llovet JM, et al. Ramucirumab after sorafenib in patients with advanced hepatocellular carcinoma and increased alpha-fetoprotein concentrations (REACH-2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2019; 20(2):282–96. https:// doi.org/10.1016/S1470-2045(18)30937-9 PMID: 30665869.
8. Kudo M, Finn RS, Qin S, Han KH, Ikeda K, Piscaglia F, et al. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial. Lancet. 2018; 391(10126):1163–73. https://doi.org/10.1016/S0140-6736(18)30207-1 PMID: 29433850.
9. Finn RS, Qin S, Ikeda M, Galle PR, Ducreux M, Kim TY, et al. Atezolizumab plus Bevacizumab in Unre- sectable Hepatocellular Carcinoma. N Engl J Med. 2020; 382(20):1894–905. https://doi.org/10.1056/ NEJMoa1915745 PMID: 32402160.
10. Maruta S, Ogasawara S, Ooka Y, Obu M, Inoue M, Itokawa N, et al. Potential of Lenvatinib for an Expanded Indication from the REFLECT Trial in Patients with Advanced Hepatocellular Carcinoma. Liver Cancer. 2020; 9(4):382–96. https://doi.org/10.1159/000507022 PMID: 32999866; PubMed Cen- tral PMCID: PMC7506220.
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)