2022-11-10 来源 : vip说

前言

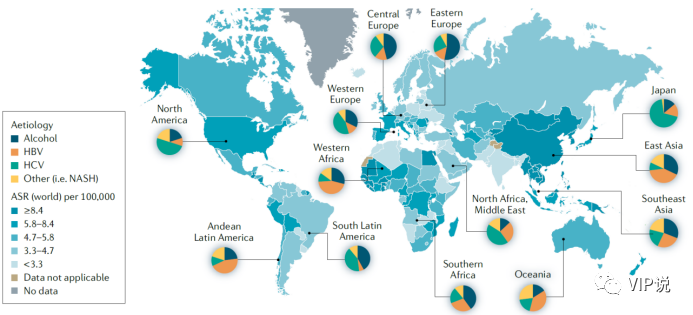
原发性肝癌(primary hepatic carcinoma, PHC) 是世界范围内流行的最常见的恶性肿瘤之一。全球年发病数超过84万/年,年死亡数超过78万/年;其中东亚、东南亚人群的肝癌发病病病死率都排在世界前列(图1)。肝癌是我国的常见恶性肿瘤,据最新的统计数据[1],肝癌发病率居男性恶性肿瘤第3位,达37万/年,死亡人数位列第2, 达32.6万/年,仅次于肺癌。高发病率和高病死率的特点使肝癌成为威胁中国人群健康的重要健康问题之一。
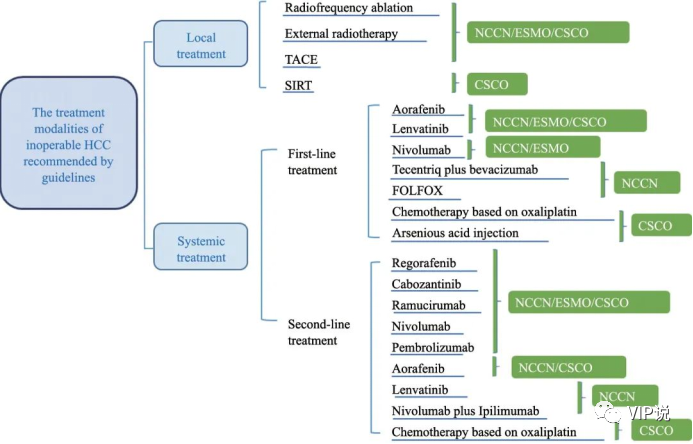
基于各个国家各个地区肝癌的背景性疾病不同,依据我国卫健委发布2022年《原发性肝癌诊疗指南》,HCC的分期主要是根据肝脏肿瘤的数目、大小、血管侵犯、肝脏转移、Child-Pugh 分级以及体力状况(PS)评分6个因素,综合判定肿瘤的分期。HCC起病隐匿,约85%的患者在确诊时已是中晚期,由于失去了手术切除的时机,只能通过使用动脉栓塞治疗、局部放射治疗等局部治疗,以及免疫治疗、靶向治疗等全身治疗来延长生存期(图2)。
阿可拉定(Icaritin、淫羊藿素软胶囊)是一种单体小分子药物,属于免疫调节抗肿瘤药物,可通过直接结合并作用于在免疫系统和癌症发生机理中起重要作用的TLR/NF-kB信号传导通道中的靶点蛋白MyD88和IKKα,调控以IL-6/JAK/STAT3 为主的炎症和免疫调节信号通路,从而调节肿瘤细胞、肿瘤免疫微环境中不同免疫细胞的多个生物学功能,包括促进肿瘤细胞凋亡,抑制肿瘤细胞生长,抑制肿瘤细胞干性,抑制炎症因子IL-6,IL-8,IL-10,TNF-α表达、抑制免疫检查点PD-L1表达。阿可拉定基于一项多中心、随机、双盲、平行对照III期临床研究---SNG1705 ICR-1而研究获得国家药品监督管理局(NMPA)批准,用于不适合或患者拒绝接受标准治疗,且既往未接受过全身系统性治疗的、不可切除的肝细胞癌。淫羊藿素软胶囊被2022版CSCO肝癌诊疗指南推荐用于晚期肝癌的治疗(1B类证据)。

病例介绍

1、基本信息
黄某某,男,78岁。因右上腹疼痛1周,于2021-07-29 就诊。
现病史:患者近期无明显诱因出现右上腹疼痛,伴饱胀感,伴嗳气,伴食欲减退,无发热,无恶心、呕吐,无反酸、烧心,就诊于当地医院。行胃镜检查:慢性萎缩性胃炎;胃窦Ⅱc病变;食管裂孔疝。上腹部CT+强化:肝内多发占位,不除外合并门静脉瘤栓;胃窦部充盈欠佳;符合双肾囊肿表现。
既往史:无特殊,有乙型肝炎病史,未予治疗,现乙肝抗原阴性。
体格检查:PS 0分。
实验室检查:
血常规:WBC 6.15×109/L,RBC 55.9×1012/L, HGB 139g/L,PLT 226×109/L。
血凝常规:凝血酶原时间 12.5s
肝功能:ALT 35.00U/L,AST 41.00 U/L,GGT 427U/L,ALB 30.4g/L,TBIL 23.68μmol/L。
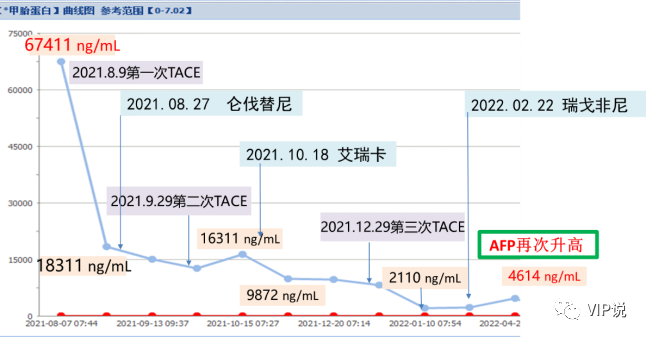
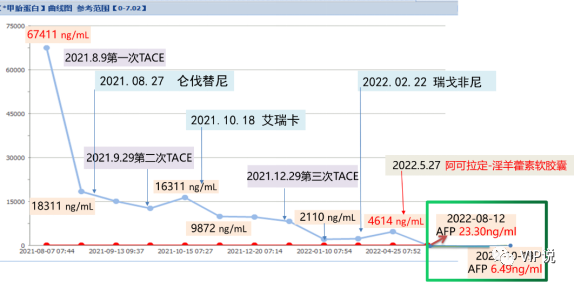
肿标:AFP 67411ng/mL
肝功能 Child-Pugh分级:A级
2、初步诊断
肝恶性肿瘤(CNLC IIIb期)
门静脉癌栓
乙型肝炎肝硬化
3、初始治疗方案
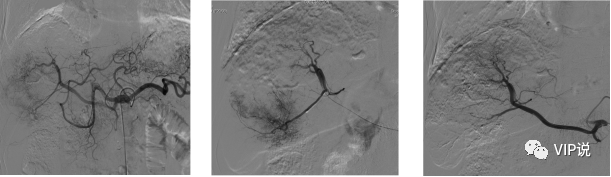
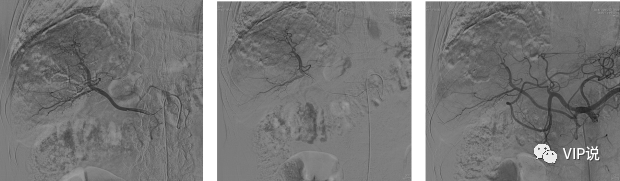
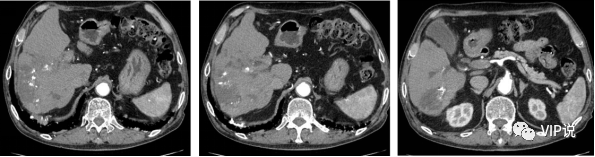
2021-08-09 第一次肝动脉化疗栓塞术:载有50mg吡柔比星的载药栓塞微球[100-300um]+雷替曲塞2mg+10ml碘化油混合液行动脉适量灌注化疗栓塞。(下图所示)
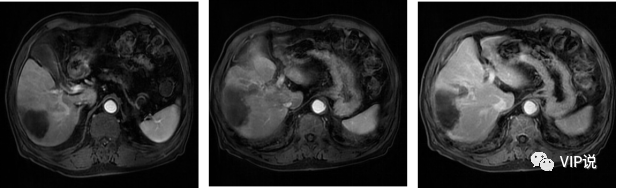
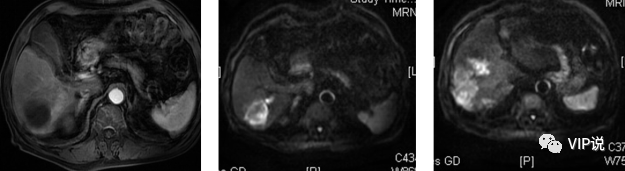
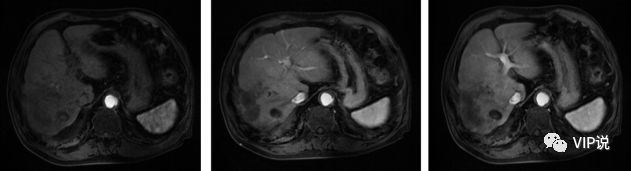
2021-09-15 上腹部强化MR 动脉期部分病灶似略呈环状强化,肝硬化。(下图所示)
2021-09-29 第二次肝动脉化疗栓塞术:吡柔比星20mg+碘化油10ml混合液行动脉灌注化疗栓塞。(下图所示)
2021-11-10 上腹部强化MR 动脉期部分病灶似略呈环状强化,肝右叶部分病变较前新发。(下图所示)
2021-12-29 第三次肝动脉化疗栓塞术:肝左支应用雷替曲塞2mg+碘化油4m混合液栓塞,肝右支应用吡柔比星30mg的100-300um载药微球行动脉栓塞。(下图所示)
介入治疗中,期间联合药物系统治疗:
Ø2021.08.27 仑伐替尼(8 mg,qd)
Ø2021.10.18 艾瑞卡(200mg iv 3周方案)
Ø2022.02.22 因瘙痒、高血压不能耐受,仑伐替尼改为二线瑞戈非尼(80 mg,qd)
2022-3-11 上腹部强化CT 肿瘤可能仍有部分活性, 肝硬化。(下图所示)
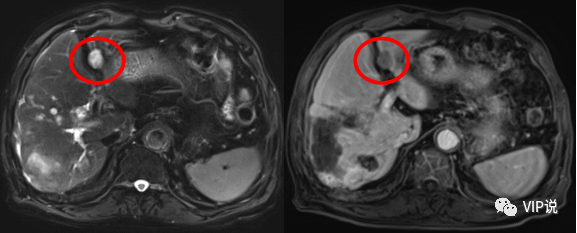
2022-5-19 上腹部增强MR提示肝左叶外侧段新发病灶。
4、肿瘤进展,调整治疗方案
2022.05.27 淫羊藿素软胶囊(300mg,bid)+ 瑞戈非尼(80 mg,qd)+ 艾瑞卡(200mg iv 3周方案)。之前靶免治疗过程中上升的AFP在加用淫羊藿素软胶囊后,AFP由4614 ng/mL降到23.30 ng/mL。且疗效显著,连续PR。
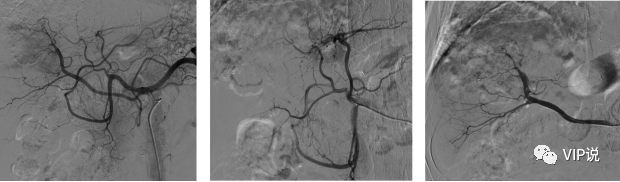
2022-08-12 上腹部MR增强:肝左叶外侧段病灶较前减小,肝硬化。(下图所示)
疗效评估:PR
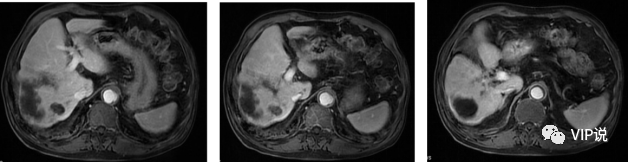
2022-10-19 上腹部MR增强:肝内病灶较前减小,未见明显强化,肝硬化。(下图所示)
疗效评估:PR
治疗过程中无不良反应,PS 0分。患者用药感受:精神好,食欲佳,体力可。

治疗展望与思考

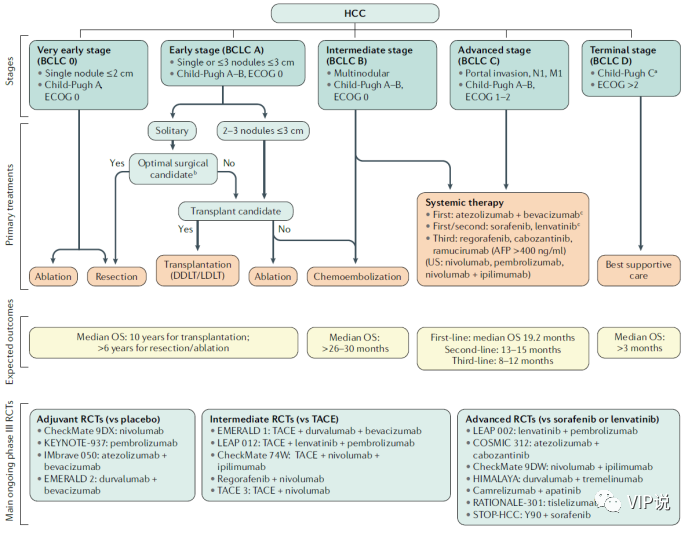
在过去十年中,HCC的治疗方案有了很大的改善。按照巴塞罗那临床肝癌(BCLC)分期系统,根据肿瘤分期和主要干预措施的预期效益来选择治疗。原则上,早期HCC患者首选切除、移植和局部消融[2],而中期患者首选TACE,晚期患者将首先接受系统性治疗(图5)。
TACE对肝癌的治疗作出了巨大贡献,使中期肝癌患者的生存延长了20个月,但仍需突破一些瓶颈问题才能进一步改善远期生存、提高临床治愈率,主要原因有以下几方面:
第一、TACE治疗难以彻底清除局部肿瘤病灶;
第二、对于非小肝癌、多结节肝癌难以达到完全性栓塞;
第三、TACE单独治疗对于伴有门静脉癌栓的肝癌治疗效果差;
第四、多次TACE后可发生抵抗、疗效减低[3];
除此此外,有些研究还提示TACE可诱发VEGF升高和免疫逃逸[4, 5]。要走出中晚期肝癌局部治疗的困境,我们需要进一步探索多种局部联合治疗手段结合的综合治疗模式,达到增强局部和全身疾病控制的效果,进一步减少复发风险。同时存在针对影响TACE远期疗效的因素[6],治疗不足会引起肝癌复发转移,目前主张TACE 联合安全性好的系统治疗药物,来控制肿瘤、提高患者生活质量和延长生存。
肝细胞癌又是一种高度炎症相关的肿瘤,在肝癌的整个发生发展过程中都伴随着持续的炎症反应,其中炎症细胞因子TNF-α、IL-6等,肝癌致癌相关通路如NF-κB、JAK/STAT、PD-1/PDL-1s等都参与其中。肿瘤坏死因子(TNF)-α是最重要的炎症细胞因子之一,提供了慢性炎症和恶性肿瘤之间的分子联系。TNF-α主要由巨噬细胞产生,多种肿瘤细胞也会产生TNF-α,促进肿瘤的侵袭和转移[7]。IL-6通过大量下游介质作用于肿瘤细胞,以支持癌细胞的增殖、生存和转移性扩散。此外,IL-6还可以通过外部作用于复杂肿瘤微环境中的其他细胞,通过支持血管生成和肿瘤逃避免疫监视来维持促肿瘤环境[8]。IL-6/JAKs/STAT3通路激活是促进肿瘤发生的主要途径[9],也是诱导TKIs耐药主要原因之一[10];另一方面,IL-6/JAK1通路的激活可促进PD-L1磷酸化,导致免疫逃逸[11]。
据大量研究报道[12-16],在肿瘤细胞中,阿可拉定可以下调TNF-α、IL-6、PD-L1等表达发挥抗肿瘤作用 ,同时通过下调TNFa 和IL-6的分泌量以及MDSC细胞比例抑制PD-L1的表达实现对肿瘤免疫微环境的调节作用。更重要的是阿可拉定的安全性极好,对患者的生活质量上也有很大的保障临床。临床研究中少见3-4级TRAE,而这在现有标准药物治疗中是常见的。
好的安全性是联合用药的前提,因此,探索最佳的用药组合值得进一步思考,阿可拉定联合局部治疗或免疫与靶向治疗有望进一步优化治疗格局。
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018; 68(6):394-424.
2. Rinella ME, Tacke F, Sanyal AJ, Anstee QM, participants of the AEW. Report on the AASLD/EASL joint workshop on clinical trial endpoints in NAFLD. J Hepatol 2019; 71(4):823-833.
3. Hiraoka A, Kumada T, Kudo M, Hirooka M, Koizumi Y, Hiasa Y, et al. Hepatic Function during Repeated TACE Procedures and Prognosis after Introducing Sorafenib in Patients with Unresectable Hepatocellular Carcinoma: Multicenter Analysis. Dig Dis 2017; 35(6):602-610.
4. Liu K, Min XL, Peng J, Yang K, Yang L, Zhang XM. The Changes of HIF-1alpha and VEGF Expression After TACE in Patients With Hepatocellular Carcinoma. J Clin Med Res 2016; 8(4):297-302.
5. Montasser A, Beaufrere A, Cauchy F, Bouattour M, Soubrane O, Albuquerque M, et al. Transarterial chemoembolisation enhances programmed death-1 and programmed death-ligand 1 expression in hepatocellular carcinoma. Histopathology 2021; 79(1):36-46.
6. Llovet JM, Zucman-Rossi J, Pikarsky E, Sangro B, Schwartz M, Sherman M, et al. Hepatocellular carcinoma. Nat Rev Dis Primers 2016; 2:16018.
7. Tan W, Luo X, Li W, Zhong J, Cao J, Zhu S, et al. TNF-alpha is a potential therapeutic target to overcome sorafenib resistance in hepatocellular carcinoma. EBioMedicine 2019; 40:446-456.
8. Fisher DT, Appenheimer MM, Evans SS. The two faces of IL-6 in the tumor microenvironment. Semin Immunol 2014; 26(1):38-47.
9. Sansone P, Bromberg J. Targeting the interleukin-6/Jak/stat pathway in human malignancies. J Clin Oncol 2012; 30(9):1005-1014.
10. Dai Z, Wang X, Peng R, Zhang B, Han Q, Lin J, et al. Induction of IL-6Ralpha by ATF3 enhances IL-6 mediated sorafenib and regorafenib resistance in hepatocellular carcinoma. Cancer Lett 2022; 524:161-171.
11. Chan LC, Li CW, Xia W, Hsu JM, Lee HH, Cha JH, et al. IL-6/JAK1 pathway drives PD-L1 Y112 phosphorylation to promote cancer immune evasion. J Clin Invest 2019; 129(8):3324-3338.
12. Hao H, Zhang Q, Zhu H, Wen Y, Qiu D, Xiong J, et al. Icaritin promotes tumor T-cell infiltration and induces antitumor immunity in mice. Eur J Immunol 2019; 49(12):2235-2244.
13. Li C, Yang S, Ma H, Ruan M, Fang L, Cheng J. Influence of icariin on inflammation, apoptosis, invasion, and tumor immunity in cervical cancer by reducing the TLR4/MyD88/NF-kappaB and Wnt/beta-catenin pathways. Cancer Cell Int 2021; 21(1):206.
14. Mo D, Zhu H, Wang J, Hao H, Guo Y, Wang J, et al. Icaritin inhibits PD-L1 expression by Targeting Protein IkappaB Kinase alpha. Eur J Immunol 2021; 51(4):978-988.
15. Zhao H, Guo Y, Li S, Han R, Ying J, Zhu H, et al. A novel anti-cancer agent Icaritin suppresses hepatocellular carcinoma initiation and malignant growth through the IL-6/Jak2/Stat3 pathway. Oncotarget 2015; 6(31):31927-31943.
16. Zhou J, Wu J, Chen X, Fortenbery N, Eksioglu E, Kodumudi KN, et al. Icariin and its derivative, ICT, exert anti-inflammatory, anti-tumor effects, and modulate myeloid derived suppressive cells (MDSCs) functions. Int Immunopharmacol 2011; 11(7):890-898.
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)