国家药审中心公布了一年一度的《中国新药注册临床试验进展年度报告》,这份报告受到重视的程度似乎远不如《年度药品审评报告》(下期话题预定~),但其中揭示了大量临床申报和推进过程中的重要信息,比如化药/生物药/中药的临床开展情况分别如何、哪些临床试验被削减了、哪些适应症临床最热门、临床获批后多长时间能启动、临床多长时间能完成等等,都能在这里找到答案。
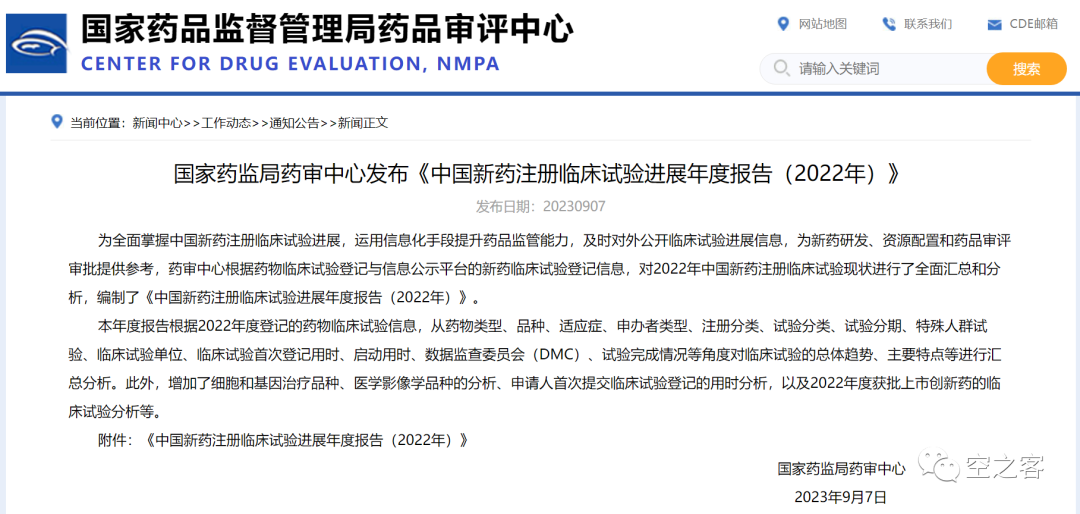
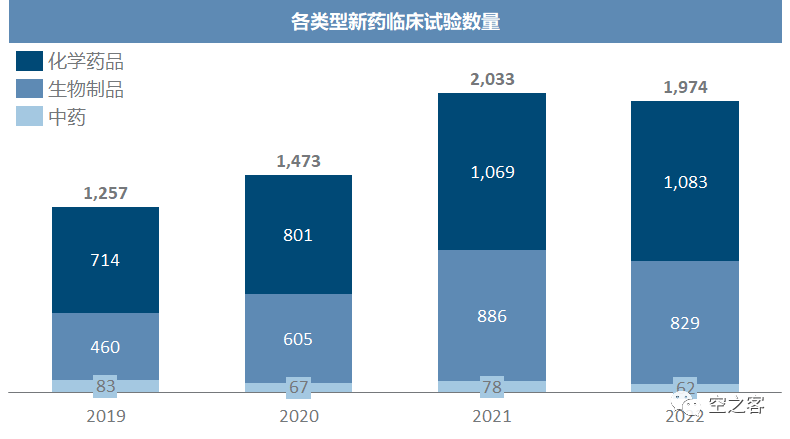
我们将2020-2022三年的报告版本进行对比,力求能够形成横向纵向的对比,以综合理解我国临床试验开展的真实情况。20版:www.cde.org.cn/main/news/viewInfoCommon/d670723dd2f646722097b03cf005e05221版:www.cde.org.cn/main/news/viewInfoCommon/1839a2c931e1ed43eb4cc7049e189cb022版:www.cde.org.cn/main/news/viewInfoCommon/46260e34bfe67292bfae1de8863d20fe临床试验数量作为医药研发活跃度最直观的体现(数量以CTR登记为准),在2021年整个医药产业的烈火烹油中出现了大幅提升,而在掉头转入寒冬的2022年仍有小幅增长。其中,化药仍保持一定正向增速,生物制品则已经从高点出现明显回落,中药则始终处于边缘地位。
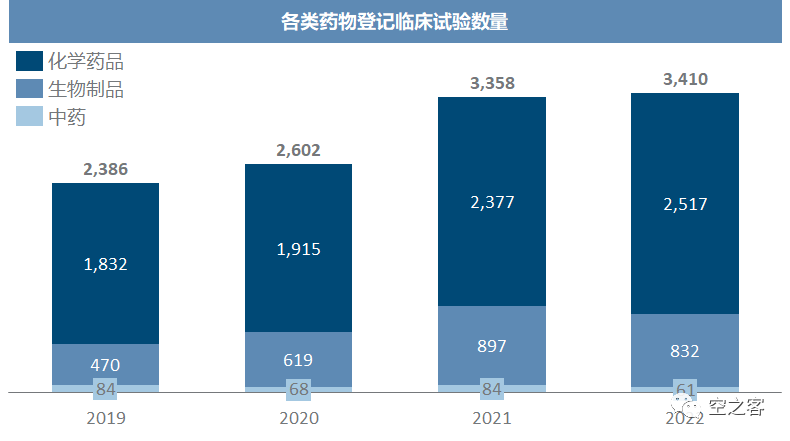
以临床试验申办者类型来分(以受理号首字母J/C来区分),本土企业的临床推进其实仍然保持较快的增速,真正大幅度削减临床的是境外申办者,甚至22年境外申办者的临床试验数量都低于19年水平。
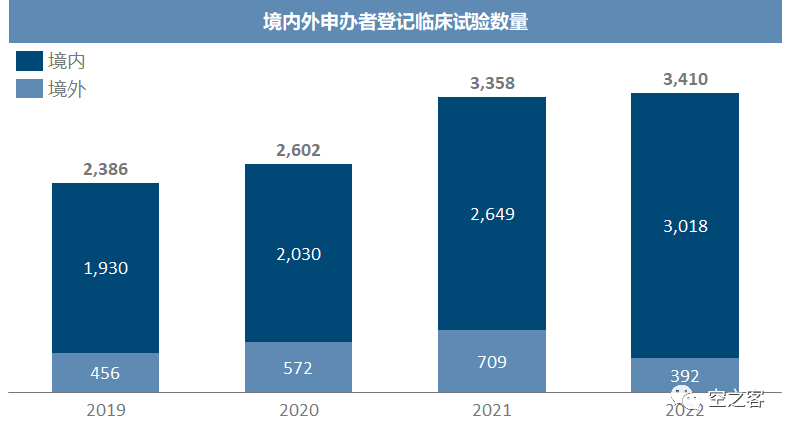
在22年医药产业资金紧缺的背景下,消耗资源更多的新药临床确实出现一定的削减,而BE依然保持正常的推进速度。
在新药临床数量中,化药始终保持着一定增速,回撤明显的是生物制品,中药新药基本就忽略不计。
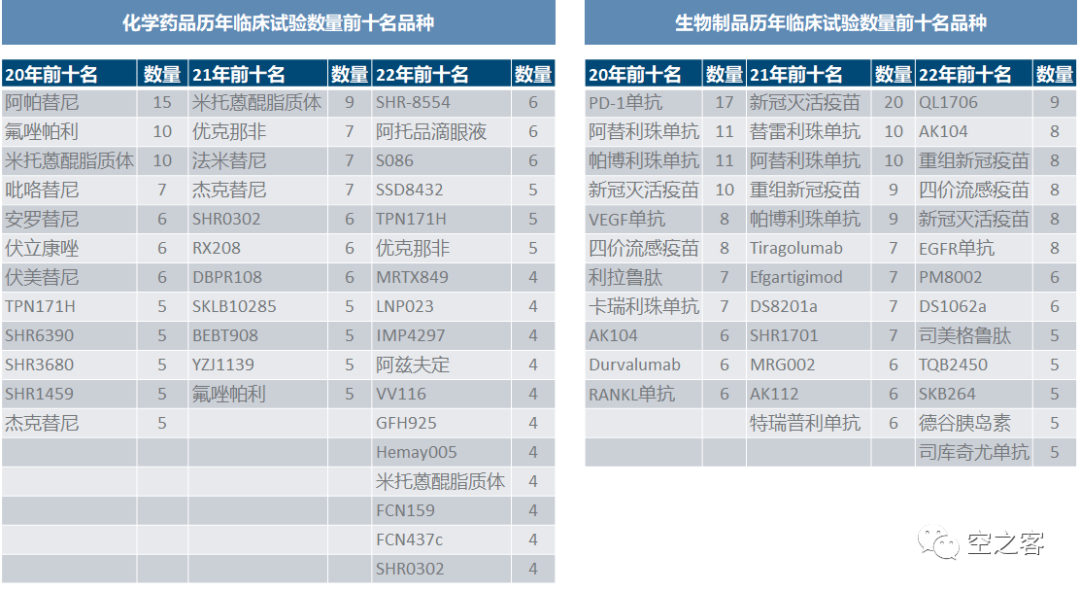
从开展临床试验最多的品种来看,一方面热度回落非常明显,22年已不复前两年那种动辄单品种10-20个临床齐头并进之盛况,尤其是生物制品又减少了新冠疫苗这一大块;另一方面化药活跃品种绝大多数都是国内企业、尤其是恒瑞出镜率颇高,而生物制品则由跨国药企占据半壁以上,中药则基本上没有同时开展一项以上的品种。22年报还首次专门开辟针对CGT和影像学品种的章节:22年细胞基因治疗产品共登记46项临床试验,其中12项间充质干细胞、9项靶向CD19的自体T细胞、2项基因治疗;医学影像学药物19-22年分别登记0/5/8/11项临床试验。
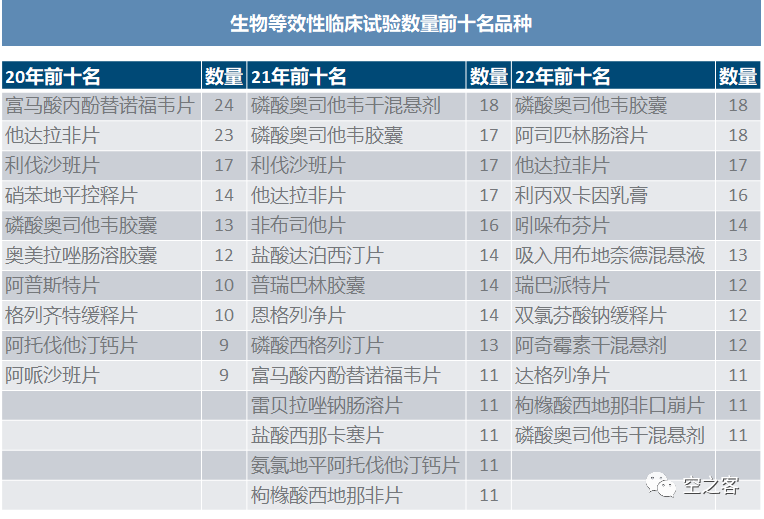
生物等效性试验的热度也同样逐渐回归理性,当然目前这样一个品种十几二十家做BE,依然是过度拥挤了。
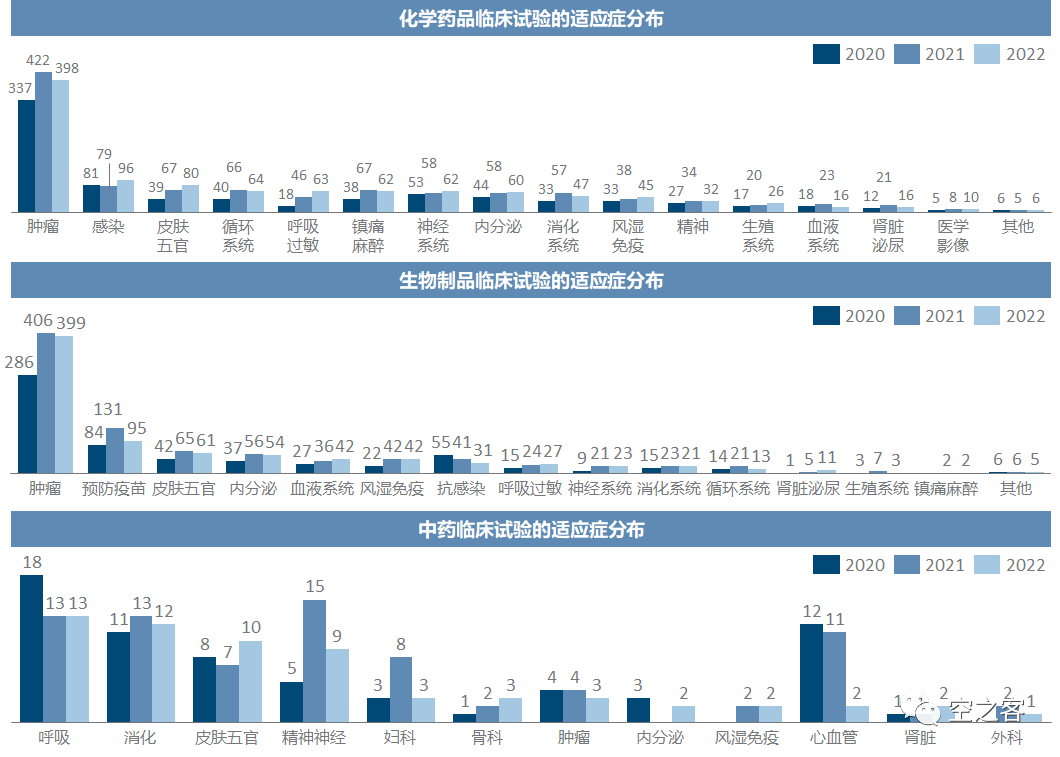
除了一直傲立临床试验数量之巅的肿瘤领域以外,呼吸系统疾病及抗过敏、皮肤及五官科、风湿性疾病及免疫都是热度提升较为明显的疾病领域。
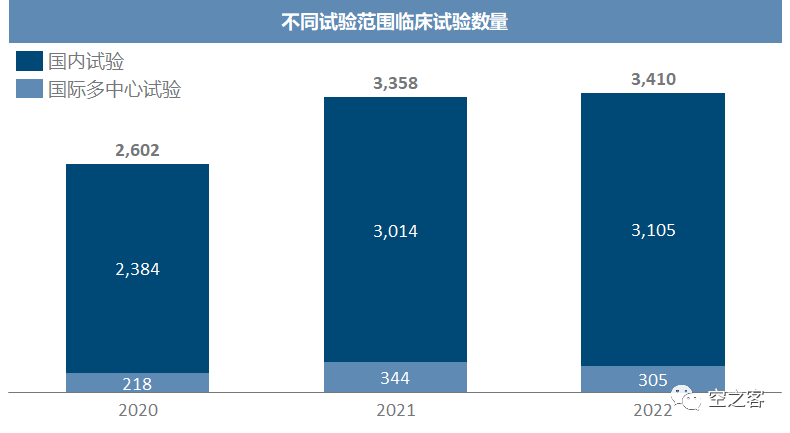
目前国际多中心试验仅占不足15%,说明国际化水准仍有巨大提升空间。
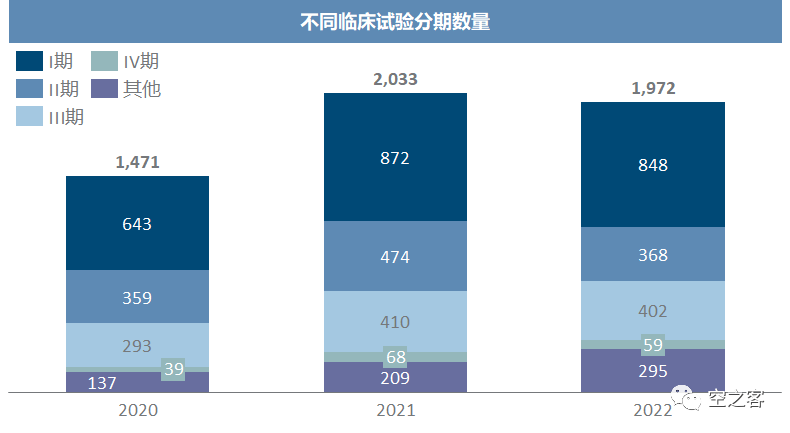
在恶劣环境中,早期临床很明显成为被削减的主要对象,而III期临床则是能保则保,毕竟这可是公司未来价(gu)值(shi)的核心。
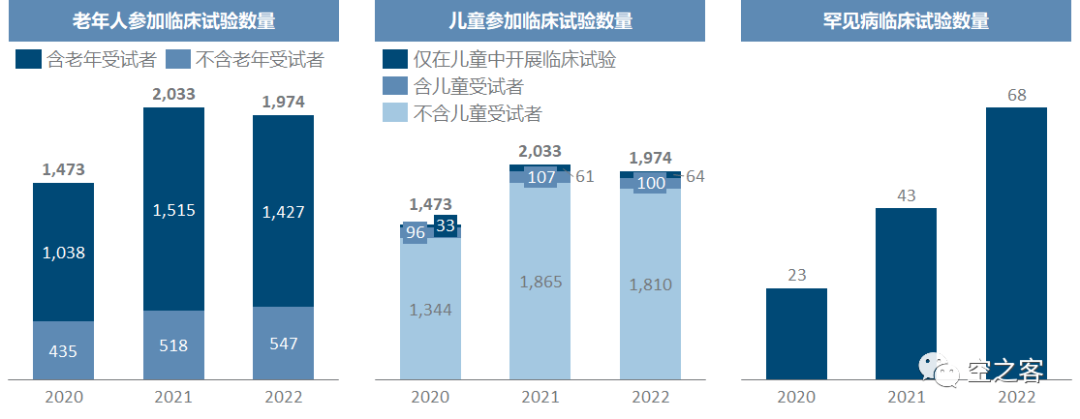
近两年都披露了不同类型和阶段的临床试验的平均入组人数,除II期的入组人数普遍增加以外,其他多数临床分期的入组要求都有所下降。老年、儿童和罕见病是近几年来药监局不断重点支持的用药人群,可以发现老年人参加的临床试验比例居多,但儿童参加的比例就显著偏低、罕见病就更无人问津。
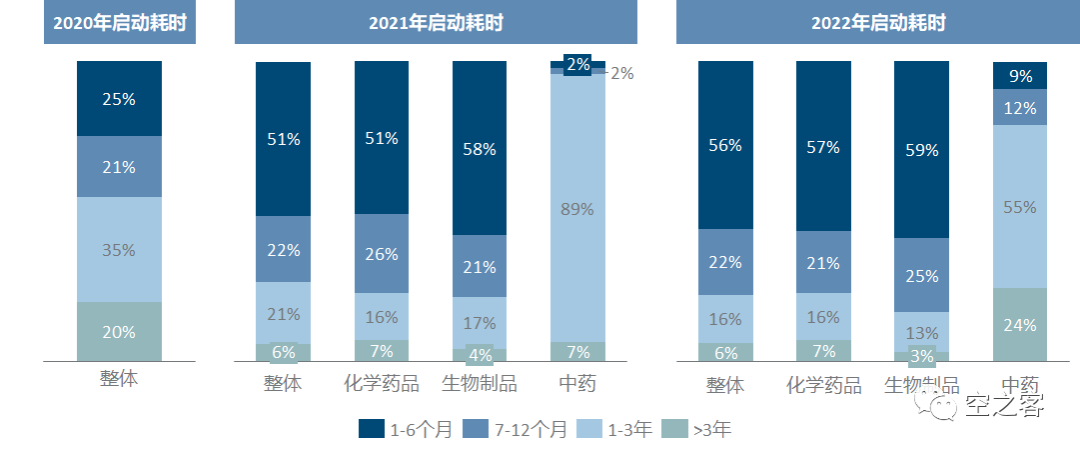
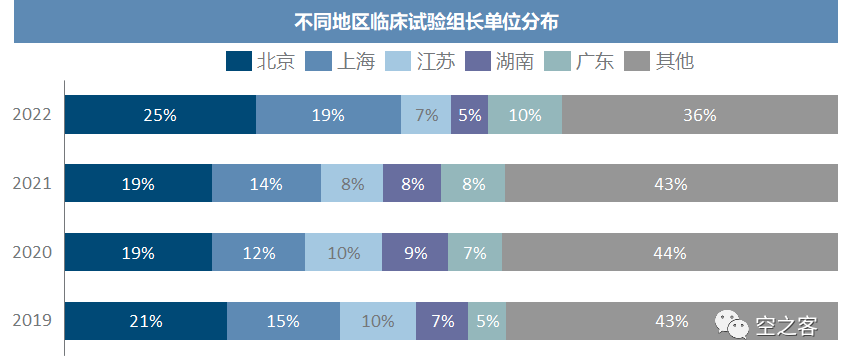
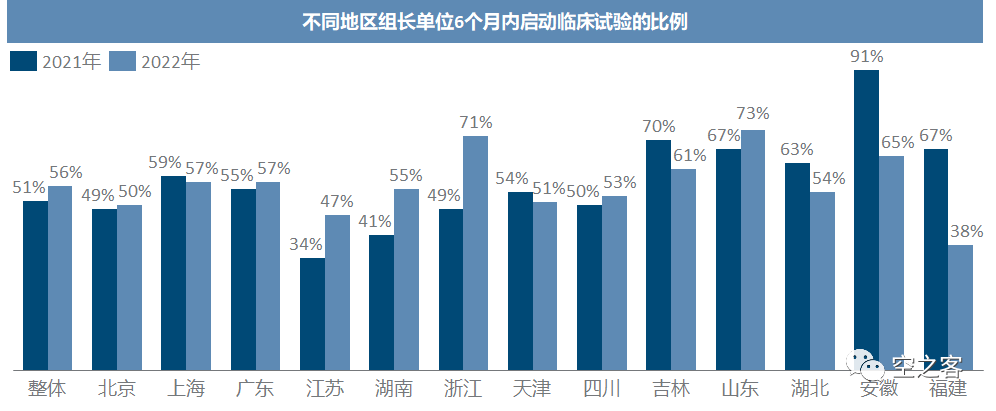
临床获批到启动所需的时间,仅三年内就发生了肉(kan)眼(cheng)可(li)见(pu)的提升,咱也不知道20年是不是因为疫情影响导致一大半临床试验在获批后一年以上才启动,更不知道为什么21年只有4%的中药临床在一年内启动,至少到22年多数化药和生物药已经能在拿到许可后半年内启动临床。临床试验的组长单位目前仍主要集中于北上广+江苏湖南等几省市,且近年来有愈发向北上广集中的趋势,这三地就已经占比超过50%。
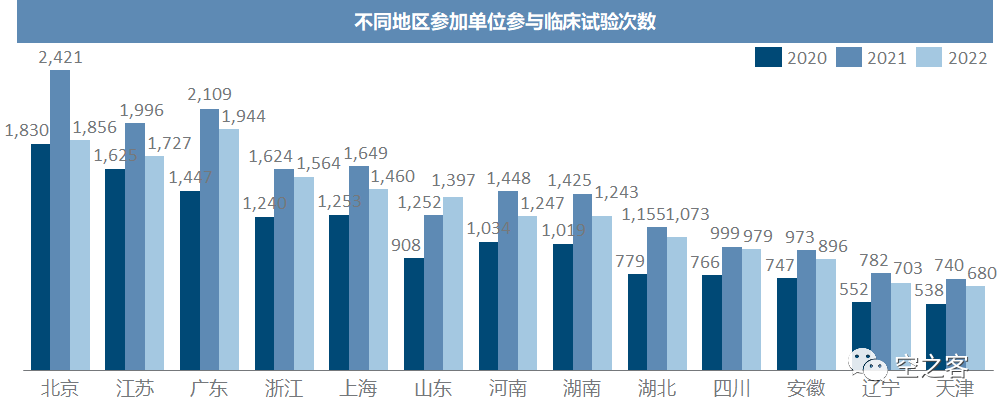
不过在作为组长单位开展临床,效率也有显著差异,北上广都还比较平均,江苏湖南却看似属于拖后腿的水平,反而是吉林山东安徽福建是优等生,这可能与临床资源的供需关系有关。临床参加单位虽然也以北上广及江浙为首,但集中度不如组长单位,如山东河南等人口大省每年也都为临床试验作出巨大贡献。
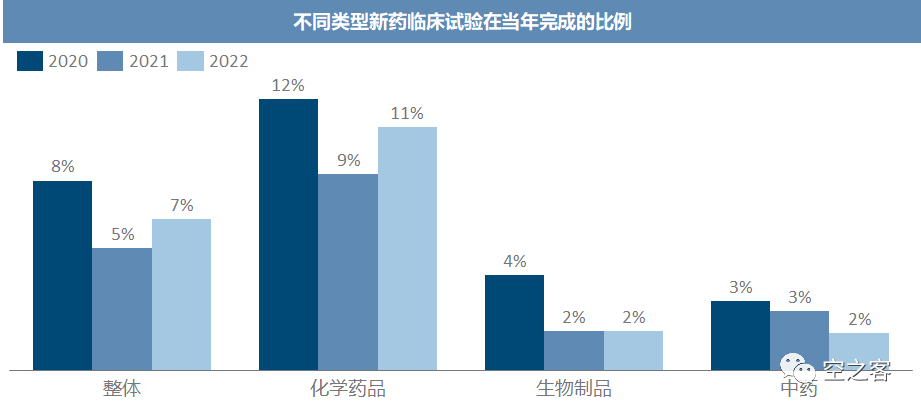
21年各类新药临床能在当年完成的比例都明显偏低,且整体而言化学药品的完成要远好于生物制品和中药。
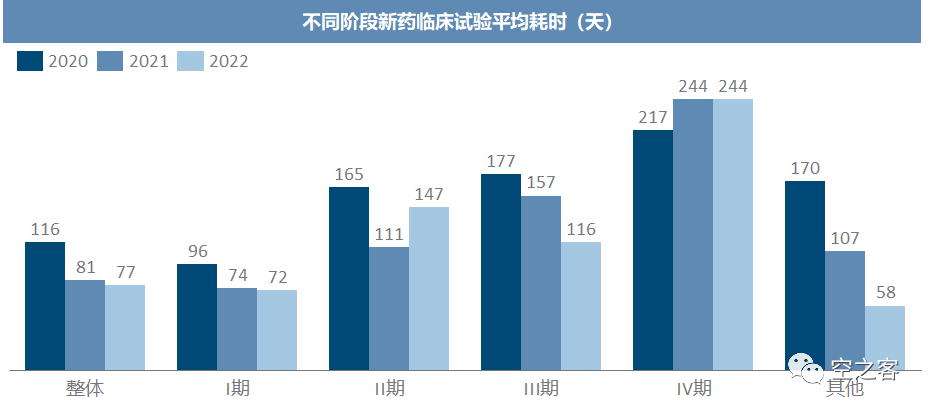
从临床试验完成的平均耗时天数来看,近几年的推进效率有显著提升,除了IV期以外,其他阶段临床耗时都有显著缩短。综合来看,我国药物临床试验的开展,在行业热度发生剧烈变化的背景下,数量调整的同时、质量和效率也在悄然发生深刻的变化,无论是扎堆重复研发的情况,还是启动和推进效率,近三年以来都有了显著的改善。
我们当然要坦然面对寒冬中的萧条肃杀,也不应忽视看似蛰伏之中所孕育的变化,当春雷唤醒沉寂,那些在冬日中积累的力量,会在春日的阳光下迸发出更加热烈的生命力。
活动中:66元/年,仅0.2元/天
畅享超过1400篇精选医药研究报告
未来一年新增额外1000篇
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。







发表评论
注册或登后即可发表评论
登录注册
全部评论(0)