2022-06-29 来源 : 聚焦CA
【引言】
本期消化道肿瘤月报,为大家梳理了Lancet Oncology, JCO, GUT 5月刊的重点内容。
那么,本期的内容中,结直肠癌术前放疗标准在哪里?
短程放化疗与长程放化疗III期临床结果发布,有何看点?
胆管癌的新标志物是什么?
一起来看看吧!

肠癌
The Lancet Oncol:
根据2020年NICE直肠癌术前新辅助放疗患者标准评估后进行单纯手术治疗对比使用MRI预后因素进行评估:一项回顾性队列研究
Assessment of the 2020 NICE criteria for preoperative radiotherapy in patients with rectal cancer treated by surgery alone in comparison with proven MRI prognostic factors: a retrospective cohort study
Lord, Amy C et al. The Lancet. Oncology vol. 23,6 (2022): 793-801.
doi:10.1016/S1470-2045(22)00214-5
期刊来源:Lancet Oncol IF:33.752
类别:临床研究
背景:直肠癌术前新辅助治疗患者的选择存在争议。新版2020年英国国家健康与护理卓越研究所(NICE)指南与美国国家综合癌症网络指南(NCCN)一致,建议对所有患者进行术前放疗,但放射学分期为T1-T2、N0肿瘤的患者除外。我们的目的是评估未进行放疗的直肠癌患者的结果,并根据NICE标准对结果进行分层,并与NICE标准与MRI预后因素进行比较。
方法:该研究为回顾性队列研究,MRI检测到壁外静脉侵犯、肿瘤沉积和周围切除边缘受累的患者被归类为MRI高复发风险(局部或远处),并将他们的结果(无病生存期、总生存期和复发)与根据NICE标准(MRI检测到T3+或MRI检测到N+状态)定义为高风险的患者进行比较。
结果:该研究评估了378例患者,中位随访时间为66个月(IQR:44个月-95个月)。378例患者中有22例患者(6%)有局部复发,有68例患者(18%)有远处复发。根据NICE标准,378人中有248人(66%)被归类为高风险,而根据MRI标准,378人中有121人(32%)被归类为高危。在Kaplan-Meier分析中,与NICE低风险患者相比,NICE高风险患者的5年无病生存期较差(76%[95%CI: 70%-81%]vs 87%[95%CI: 80%-92%];风险比[HR]:1·91[95%CI: 1·20–3·03];p=0·0051),但5年总生存期无显著统计学差异(80%[[95%CI: 74%–84%]vs 88%[[95%CI: 81%–92%];HR: 1·55[0·94–2·53];p=0·077)。MRI标准将患者分为预测5年无病生存期的高风险组和低风险组(66%[95%CI: 57%–74%]vs 88%[[95%CI: 83%-91%];HR: 3·01[95%CI: 2·02–4·47];p<0·0001)和5年总生存期(71%[[95%CI: 62%-78%]vs89%[[95%CI: 84%-92%];HR: 2·59[1·62-3·88];p<0·0001)。在多变量分析中,NICE风险评估与无病生存或总生存无关,而MRI标准预测无病生存(HR: 2·74[95%CI: 1·80–4·17];p<0· 0001)和总生存期(HR: 2·44[95%CI: 1·51–3·95];p=0·00027)。139例NICE标准高风险患者,按照MRI标准被定义为低风险,而这些患者与118例NICE低风险患者的无病生存期相似。因此,该研究队列中37%(378例中的139例)的患者参照了NICE 2020指南进行了过度治疗。在NICE标准定义为低风险的130例患者中,有12例患者在MRI风险分层上被定义为高风险,可能会错过治疗。
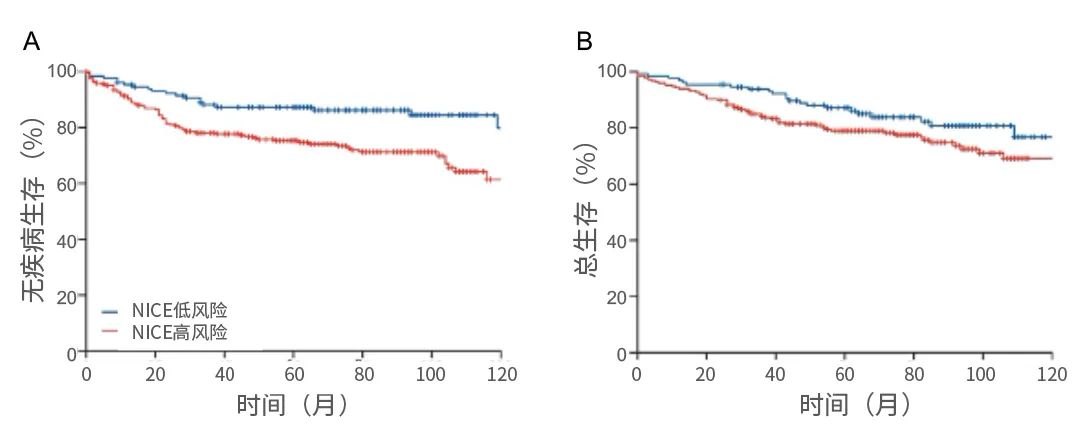
图1. 根据NICE风险评估的无病生存期和总生存期

图2. 根据MRI风险评估的无病生存期和总生存期
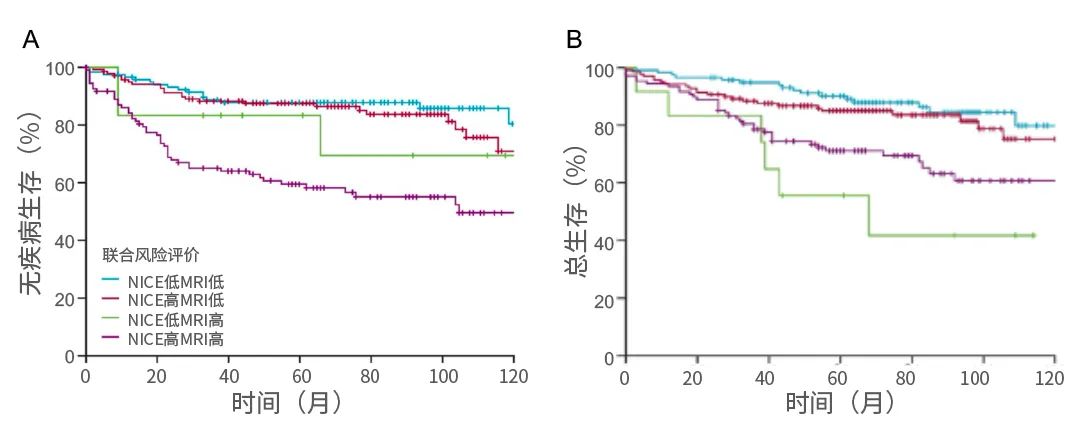
图3. 根据联合NICE和MRI风险评估的无病生存期和总生存期
结论:相较于以往的指南,根据2020 NICE指南的实施筛选并导致更多的患者接受术前新辅助放疗。高质量的MRI可以筛选出未进行放疗但预后良好(特别是局部复发率低)的患者,但是,根据非选择性一刀切的方法,筛选出需要进行术前新辅助放疗的患者,可能会导致过度使用放疗。而使用MRI预后因素(壁外静脉侵犯、肿瘤沉积和环切缘)取代NICE标准去进行筛选,可以更好得识别出术前新辅助放疗获益最佳的人群。
同期评论:高危直肠癌的个体化治疗:一刀切合理吗?
Personalised care for high-risk rectal cancer: does one size fit all?
Britt JP Hupkens教授同期发表在The Lancet Oncology上的对于NICE在直肠癌术前放疗的指导意义。NICE指南主要基于历史上随机对照试验数据,例如瑞典直肠癌试验(25Gy联合直肠手术vs单纯手术),荷兰TME试验(25Gy联合全直肠系膜切除术TME对比单独TME)显示,未经挑选的患者中使用术前放疗可将局部复发率降低至5%左右,对总生存期没有影响。荷兰TME试验的局部复发率与Lord教授的研究中未接受新辅助治疗的患者的局部复发率相似。新辅助治疗对所有患者的益处可能很小,并且可能导致更多潜在的副作用。所以,在直肠癌患者的治疗中,一刀切的原则并不适用,应采用更加个性化的治疗策略。根据NICE标准属于高危,但根据MRI标准属于低危的患者,应该判断自己愿意承担的疾病复发和治疗副作用的风险,做出自己的选择。前瞻性的多中心试验将有助于确定适合个体患者的最佳新辅助治疗,并以最佳方式告知患者,从而优化共同决策。
Lancet Oncol:
一线FOLFOXIRI+贝伐珠单抗联合或不联合阿替利珠单抗治疗转移性结直肠癌(AtezoTRIBE):一项多中心、开放标签、随机、对照、2期试验
Upfront FOLFOXIRI plus bevacizumab with or without atezolizumab in the treatment of patients with metastatic colorectal cancer (AtezoTRIBE): a multicentre, open-label, randomised, controlled, phase 2 trial
Antoniotti, Carlotta et al. The Lancet. Oncology, S1470-2045 (22) 00274-1. 27 May. 2022, doi:10.1016/S1470-2045 (22)00274-1
期刊来源:Lancet Oncol IF:33.752
类型:临床试验
背景:
FOLFOXIRI联合贝伐珠单抗可能增加错配修复功能完整(pMMR)或微卫星稳定(MSS)肿瘤的免疫原性,该研究旨在为转移性结直肠癌患者在一线FOLFOXIRI加贝伐珠单抗中添加抗PD-L1药物阿替利珠单抗带来益处的初步证据。
方法:AtezoTRIBE是一项多中心、开放标签、随机、对照、2期临床研究,其招募的标准为年龄18-70岁,体能状态为0-2,经组织学证实、不可切除、先前未治疗的转移性结直肠癌。将患者随机分配(1:2)到两组:对照组接受一线FOLFOXIRI(静脉内165mg/m2伊立替康、85mg/m2奥沙利铂、200mg/m2亚叶酸和3200mg/m2氟尿嘧啶48小时输注)加贝伐珠单抗(5mg/kg静脉注射),阿替利珠单抗组接受相同的方案加阿替利珠单抗(840mg静脉注射)。根据随机分组,联合治疗最多进行8个14天周期,随后使用氟尿嘧啶和亚叶酸加贝伐珠单抗联合或不联阿替利珠单抗维持治疗,直至疾病进展、不可接受的不良事件或同意撤回。主要终点是无进展生存期,通过意向治疗原则进行分析。在接受至少一剂研究治疗的患者中评估安全性。
结果:在2018年11月30日至2020年2月26日期间,218例患者被随机分配并接受治疗(对照组73例,阿替利珠单抗组145例)。在数据截止时(2021年8月1日),中位随访时间为19·9个月(IQR:17·3个月-23·9个月)。阿替珠单抗组的中位无进展生存期为13·1个月(80%CI:12·5个月-13·8个月),对照组为11·5个月(80%CI:10·0个月-12·6个月)(风险比[HR]:0·69[80%CI:0·56-0·85];p=0·012;调整后的HR:0·70[80%CI:0·57-0·87];对数秩检验p=0·018)。最常见的全因3-4级不良事件是中性粒细胞减少症(阿替珠单抗组142例患者中的59例[42%]对比对照组72例患者中的26例[36%])、腹泻(21例[15%]对比9[13%])和发热性中性粒细胞减少症(14[10%]对7[10%])。阿替利珠单抗组39例(27%)患者和对照组19例(26%)患者报告了严重不良事件。阿替利珠单抗组报告了两例(1%)与治疗相关的死亡(由于急性心肌梗死和支气管肺出血);对照组没有报告。
结论:在一线FOLFOXIRI加贝伐珠单抗的基础上加用阿替利珠单抗是安全的,并且可以提高既往未经治疗的转移性结直肠癌患者的无进展生存期。
JCO:
局部晚期直肠癌短程放疗联合化疗与长程放化疗的多中心、随机、III期试验(STELLAR)
Multicenter, Randomized, Phase III Trial of Short-Term Radiotherapy Plus Chemotherapy Versus Long-Term Chemoradiotherapy in Locally Advanced Rectal Cancer (STELLAR)
Jin, Jing et al. Journal of clinical oncology : official journal of the American Society of Clinical
Oncology vol. 40,15 (2022): 1681-1692.
doi:10.1200/JCO.21.01667
期刊来源:JCO IF:32.956
类型:临床试验
目的:明确局部晚期直肠癌短程放疗联合化疗的疗效不劣于标准长程放化疗方案
患者和方法:患有直肠远端或中三分之一、临床原发性肿瘤3-4期和/或区域淋巴结阳性直肠癌的患者被随机分配(1:1)。TNT组在1周内接受5次5Gy短期放疗,放疗完成后7-14天进行四个周期的CAPOX(奥沙利铂130 mg/m2,每天一次,第1天+卡培他滨1,000mg/m2,每天两次,从第1天到第14天)。CRT组在5周内分25次进行50Gy,同时使用卡培他滨(825mg/m2,每天两次)。术后化疗包括TNT组2个周期的CAPOX或CRT组6个周期的CAPOX。主要终点是3年无病生存期(DFS)。
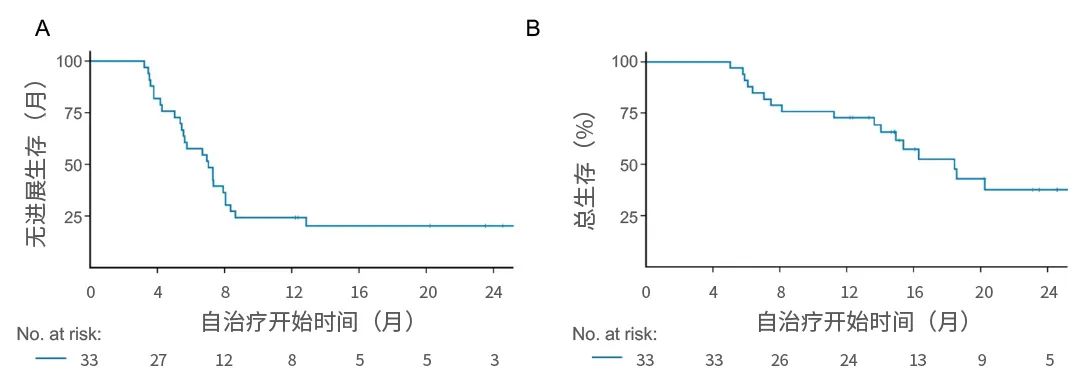
结果:2015年8月至2018年8月期间,共有599例患者被随机分配接受TNT(n=302)或CRT(n=297)。在中位随访35.0个月时,TNT和CRT组的3年DFS率分别为64.5%和62.3%(风险比,0.883;单侧95%CI,不适用于1.11;P<0.001非劣效性)。无转移生存率或局部复发率无显着差异,但TNT组的3年总生存率优于CRT组(86.5%vs75.1%;P=0.033)。无论预后因素如何,治疗对DFS和总生存期的影响相似。TNT组术前治疗期间急性III-V级毒性的发生率为26.5%,而CRT组为12.6%(P<0.001)
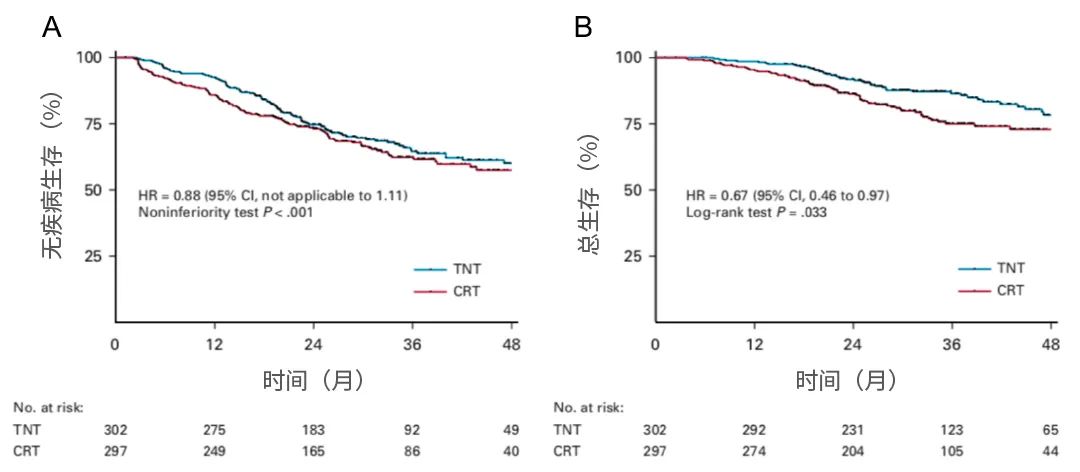
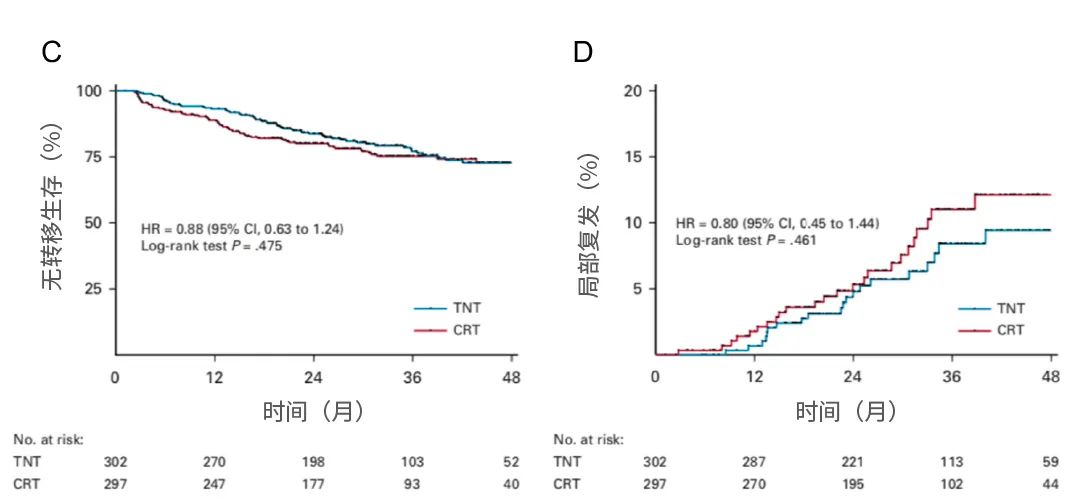
图5. 生存曲线图
结论:术前化疗联合短程放疗有效且毒性可接受,可作为局部晚期直肠癌的CRT替代疗法。
JCO:
替莫唑胺联合低剂量伊匹木单抗和纳武利尤单抗治疗微卫星稳定、O6-甲基鸟嘌呤-DNA甲基转移酶沉默的转移性结直肠癌患者:MAYA试验
Temozolomide Followed by Combination With Low-Dose Ipilimumab and Nivolumab in Patients With Microsatellite-Stable, O6-Methylguanine–DNA Methyltransferase–Silenced Metastatic Colorectal Cancer: The MAYA Trial
Morano, Federica et al. Journal of clinical oncology: official journal of the American Society of Clinical Oncology vol. 40,14 (2022): 1562-1573.
doi:10.1200/JCO.21.02583
期刊来源:JCO IF:32.956
类型:临床试验
目的:
这是一项多中心、单臂II期试验,评估免疫增敏策略在微卫星稳定(MSS)和O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)-沉默的转移性结直肠癌(mCRC)患者中的疗效和安全性。
患者和方法:对接受过治疗的mCRC患者进行集中预筛查MSS状态和MGMT沉默(即免疫组化缺乏MGMT表达加上焦磷酸测序MGMT甲基化)。符合条件的患者接受了两个初始周期的口服替莫唑胺150mg/sqm,每天一次,第1-5天,每4周一次(第一个治疗部分),随后在没有进展的情况下,与伊匹木单抗1mg/kg每8周一次组合并联合纳武利尤单抗480mg每4周一次(第二个治疗部分)。主要终点是从开始第二个治疗部分的患者入组计算的8个月无进展生存(PFS)率,在8个月时间点作为决策规则的27例受试者中有≥4例无进展。
结果:在716例预筛选患者中,204例(29%)符合分子标准,135例开始了第一个治疗部分。其中,102例(76%)因替莫唑胺引发死亡或疾病进展而停止治疗,而达到疾病控制的33例(24%)患者开始第二个治疗部分并代表最终研究人群。中位随访23.1个月(四分位距:14.9-24.6个月)后,8个月PFS率为36%。中位PFS和总生存期分别为7.0个月和18.4个月,总缓解率为45%。3-4级免疫相关不良事件为皮疹(6%)、结肠炎(3%)和垂体炎(3%)。未报告意外的不良事件或与治疗相关的死亡。
结论:MAYA研究提供了概念验证,替莫唑胺联合低剂量伊匹木单抗和纳武利尤单抗可能会在MSS和MGMT沉默的mCRC中产生持久的临床益处。
Gut:
粪便隐性失血可准确预测结直肠癌的未来-预测模型
Faecal occult blood loss accurately predicts future detection of colorectal cancer. A prognostic model
Meester, Reinier G S et al. Gut, gutjnl-2022-327188. 10 May. 2022,
doi:10.1136/gutjnl-2022-327188
期刊来源:Gut IF:19.819
推荐理由:结直肠癌的预测模型较为广泛,其中粪便隐血实验是极其重要的检测手段,该研究评估了粪便隐血预测结直肠癌的未来的关系。
类型:临床预测模型
目的:研究在基于粪便免疫化学测试(FIT)的结直肠癌(CRC)筛查中重复粪便血红蛋白(F-Hb)浓度测量的预测潜力。
设计:预后模型。
结果:有265,881位参与者完成了三轮FIT,均被纳入分析。在研究参与者中,8806人(3.3%)的FIT结果呈阳性,3254人(1.2%)检测到高级别瘤变(AN),557人(0.2%)患有癌症。第1轮和第2轮中的F-Hb浓度是最强的结果预测因子,最高F-Hb类别的调整后OR高达9.4(95%CI:7.5至11.7)。风险预测与大多数参与者观察到的风险相匹配(校准截距-0.008至-0.099;斜率0.982-0.998),区分有无AN或CRC的参与者,C统计量为0.78(95%CI:0.77至0.79)和0.73(95%CI:0.71至0.75)。AN的预测风险范围为0.4%至6.7%,CRC的预测风险范围为0.0%至5.5%。在外部验证中,该模型对AN(C统计量0.77,95%CI:0.66至0.87)和CRC(C统计量0.78,95%:CI0.66至0.91)保持了相似的区分精度。
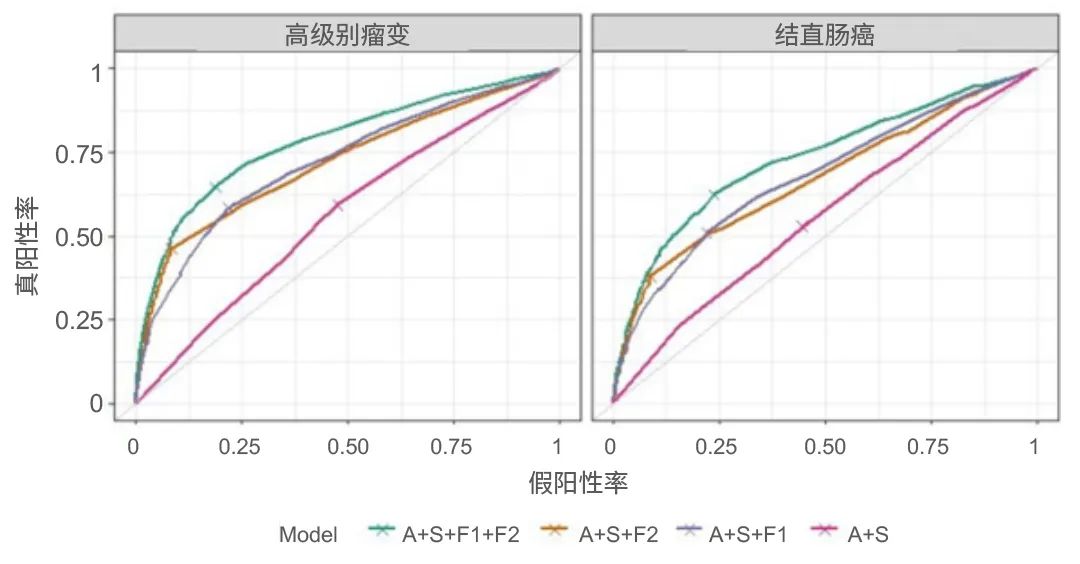
图4. FIT预测患者筛检结果受试者工作特征曲线
结论:F-Hb浓度准确识别未来AN或CRC风险较低和较高的患者。应根据此信息考虑风险分层。
肝癌
Gut:
CXCR2抑制使NASH-HCC免疫治疗成为可能
CXCR2 inhibition enables NASH-HCC immunotherapy
Leslie, Jack et al. Gut, gutjnl-2021-326259. 27 Apr. 2022,
doi:10.1136/gutjnl-2021-326259
期刊来源:Gut IF:19.819
类型:临床研究
背景:原发性肝癌是全球最常见和最致命的恶性肿瘤之一,2020年有90.5万新诊断病例和 83万例死亡。肝细胞癌(HCC)占原发性肝癌的85%,由于肥胖和代谢综合征的患病率增加,现在大部分HCC归因于非酒精性脂肪性肝炎(NASH),在英国和美国被确定为HCC最常见的危险因素。肝细胞癌(HCC)与非酒精性脂肪性肝炎(NASH)的相关性越来越高。HCC免疫疗法前景广阔,然而,最近的数据表明NASH-HCC可能对传统的免疫检查点抑制剂(ICI)不太敏感。假设使用CXCR2小分子抑制剂靶向中性粒细胞可能会使NASH-HCC对ICI治疗敏感。
设计:中性粒细胞浸润在人类HCC和小鼠HCC模型中进行了表征。在NASH-HCC的小鼠模型中进行了抗PD-1和/或CXCR2抑制剂的晚期干预。肿瘤免疫微环境通过成像质谱流式细胞术、RNA-seq和流式细胞术进行表征。
结果:表达CXCR2的中性粒细胞(一种对急性损伤中中性粒细胞募集至关重要的受体)在人NASH-HCC中具有高度代表性。在对ICI缺乏反应的NASH-HCC模型中,CXCR拮抗剂与PD-1的组合抑制了肿瘤负荷并延长了生存期。联合治疗增加了与抗肿瘤免疫相关的肿瘤内XCR1+树突状细胞活化CD8+T细胞数量。治疗获益伴随着肿瘤相关中性粒细胞(TAN)的而增加,其从原发性转变为抗肿瘤祖细胞样中性粒细胞表型。发现重编程的TAN与富含细胞毒性抗肿瘤蛋白酶颗粒酶B的簇中的CD8+T细胞直接接触。在循环中未观察到中性粒细胞重编程,表明联合治疗选择性地影响TAN。
结论:CXCR2抑制诱导肿瘤免疫微环境重编程,从而促进NASH-HCC中的ICI敏感性。
同期评论:未成熟的中性粒细胞使NASH-HCC中的抗PD-1疗法走向成熟
Immature neutrophils bring anti-PD-1 therapy in NASH-HCC to maturity
肝癌仍然是全球健康负担,肝细胞癌(HCC)约占原发性肝癌病例的90%。HCC,病毒以及非病毒原因,特别是与NASH相关HCC在过去十年中大幅增加,预计还会进一步增加。NASH是非酒精性脂肪性肝病(NAFLD)的高级形式,其特征是肝脏中脂质积累和代谢损伤导致的慢性肝脏炎症。NASH中的这种炎症性肝脏环境对于驱HCC至关重要,因此HCC甚至可以在非肝硬化NASH肝脏中发展。免疫检查点抑制(ICI)作为HCC的新一线全身治疗引起了人们的极大关注,ICI作为肿瘤防御的一部分的“T细胞活化”在NASH相关与病毒诱导的HCC中是否同样有效?事实上,最近的一项荟萃分析表明,基于ICI的方案在NASH-HCC中的疗效降低,这可能与NASH-HCC肝脏中独特的免疫环境有关,其特点是免疫抑制和促炎环境的结合。在这些肝脏中,不仅存在耗尽的肿瘤特异性PD-1+CD8+T细胞,而且还存在组织损伤性、自身攻击性CXCR6+PD-1+CD8+T细胞,这解释了为什么PD-1疗法在NASH诱导的HCC中也可能具有促肿瘤作用。显然,需要对NASH诱导的HCC进行优化的免疫疗法,以特异强化肿瘤特异性CD8+T细胞以促进抗肿瘤免疫。在本期Gut中,Leslie等人强调肿瘤相关中性粒细(TAN)作为NASH-HCC的潜在机制贡献者和潜在治疗靶点。
胆管癌
Gut:
基于微环境的肝内胆管癌创新分类具有治疗意义
Novel microenvironment-based classification of intrahepatic cholangiocarcinoma with therapeutic implications
Martin-Serrano, Miguel A et al. Gut, gutjnl-2021-326514. 18 May. 2022,
doi:10.1136/gutjnl-2021-326514
期刊来源:Gut IF:19.819
类型:基因
目的:肝内胆管癌(iCCA)肿瘤微环境(TME)的多样性尚未得到全面评估。我们的目标是生成一种新的分子iCCA分类器,该分类器包含基质、肿瘤和免疫微环境的元素(“STIM”分类)。
设计:我们将虚拟反卷积应用于来自约900个iCCA的转录组数据,从而我们能够通过选择最相关的TME组件来设计一种新颖的分类。通过流体动力学尾静脉注射产生鼠模型并与人类疾病进行比较。
结果:iCCA由五个强大的STIM类别组成,包括发炎(35%)和非发炎特征(65%)。炎症类,称为免疫经典(~10%)和炎症基质(~25%),在致癌途径和结缔组织形成程度方面不同,炎症基质显示T细胞衰竭、丰富的基质和KRAS突变(p<0.001)。细胞间相互作用的分析强调癌症相关的成纤维细胞亚型是免疫逃避的潜在介质。在非炎症类中,沙漠样类(~20%)具有最低的免疫浸润,具有丰富的调节性T细胞(p<0.001),而肝干细胞类(~35%)富含“M2样”巨噬细胞、IDH1/2和BAP1突变以及FGFR2融合。其余类别(经典肿瘤:~10%)由细胞周期途径和不良预后定义。比较分析揭示了KRAS/p19小鼠模型与炎症基质类别之间的高度相似性(p=0.02)。KRAS-SOS抑制剂BI3406使KRAS突变iCCA鼠模型对抗PD-1治疗敏感。
结论:我们描述了基于TME的综合iCCA分层。跨物种分析建立了与人类iCCA密切相关的小鼠模型,用于联合策略的临床前测试。
Gut:
胆管癌中生物标志物的临床相关性:重要修订和未来方向
Clinical relevance of biomarkers in cholangiocarcinoma: critical revision and future directions
Macias, Rocio I R et al. Gut, gutjnl-2022-327099. 17 May. 2022,
doi: 10.5935/1518-0557.20200064
期刊来源:Gut IF:19.819
类别:综述
论文关键信息:
1、常规组织学检查足以进行正确的诊断,并且在需要时,在大多数情况下,特异性免疫组织化学检查可明确诊断。
2、常规组织学和一些组织生物标志物被描述为对患者预后和风险分层有价值。
3、需要在大型多中心研究或长期观察性或介入性研究中评估和验证用于预后的问题生物标志物。
4、药耐性与摄取转运蛋白或输出泵的表达以及PD-L1的表达有关。
5、主要的靶向治疗是那FGFR-2融合和IDH-1/2突变的治疗。
胰腺癌
Gut:
PI3K-C2γ的缺乏使PDAC细胞对mTOR抑制剂敏感
Lysosomal lipid switch sensitises to nutrient deprivation and mTOR targeting in pancreatic cancer
De Santis, Maria Chiara et al. Gut, gutjnl-2021-325117. 27 May. 2022,
doi:10.1136/gutjnl-2021-325117
期刊来源:Gut IF:19.819
类型:基因
目的:胰腺癌(PDAC)是一种侵袭性疾病,治疗选择有限。针对mTORC1的关键代谢调节机制靶点及其下游途径仅在部分患者中显示出疗效,但提高疗效的基因修饰剂仍有待确定。
设计:研究了三个独立的PDAC患者队列,以将PI3K-C2γ蛋白丰度与疾病结果相关联。然后在存在或不存在PI3K-C2γ(WT或KO)的情况下,在小鼠(KPC小鼠)和PDAC细胞模型中研究机制。在限制谷氨酰胺可用性的条件下评估了PI3K-C2γ依赖性代谢重新布线及其对mTORC1调节的影响。最后,在WT和KOPDAC细胞和临床前模型中研究了针对mTORC1和谷氨酰胺代谢的联合疗法的效果。
结果:大约30%的PDAC病例中PI3K-C2γ表达降低,并且与侵袭性表型相关。同样,KPC小鼠中PI3K-C2γ的缺失增强了肿瘤的发展和进展。缺乏PI3K-C2γ的肿瘤的侵袭性增加与mTORC1通路的过度激活和谷氨酰胺代谢重新布线以支持脂质合成相关。PI3K-C2γ-KO肿瘤无法适应谷氨酰胺耗竭诱导的代谢应激,导致细胞死亡。
结论:PI3K-C2γ的缺失可防止mTOR失活并引发肿瘤对RAD001(mTOR抑制剂)和BPTES/CB-839(谷氨酰胺酶抑制剂)的易感性。因此,这些结果可能为PDAC中PI3K-C2γ丢失的个性化治疗开辟道路。
特约编辑:玉米花
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)