2022-10-27 来源 : 学术查
今天带来的思路来自“LSD1 deletion decreases exosomal PD-L1 and restores T-cell response in gastric cancer”,今年3月在Molecular Cancer(IF 41.444)上线。主要讲的是LSD1的缺失能够降低外泌体中PD-L1的表达并恢复胃癌中的T细胞反应。

文献链接:LSD1 deletion decreases exosomal PD-L1 and restores T-cell response in gastric cancer - PMC (nih.gov)
文章导读
LSD1在2004年被表征为第一个组蛋白去甲基化酶,参与广泛的生物过程,包括细胞发育、分化、生长、迁移和干性,且在多种癌症中充当癌基因。LSD1 的表达已被证明在胃癌(GC) 中升高并促进了 GC 的增殖和转移,而用其抑制剂治疗则抑制了 GC 细胞的生长、侵袭和迁移。LSD1还可以通过调节由NK细胞、巨噬细胞极化介导的肿瘤微环境来促进肿瘤的发展过程。在这篇文章中,通过比较 LSD1 在免疫缺陷小鼠和正常小鼠中的功能,发现 LSD1 通过抑制 GC 中的T细胞活性来维持肿瘤的生长,而LSD1缺失降低了 PD-L1 的总表达。
外泌体是由正常细胞和癌细胞分泌的一类直径为 30-150 nm 的小囊泡,有报道称外泌体可通过传递PD-L1以抑制抗癌免疫。在此项研究中,确定了PD-L1被GC细胞衍生的外泌体所携带,并且发现GC细胞在 LSD1 被沉默时维持细胞膜上PD-L1的表达并减少外泌体中的PD-L1。同时,LSD1缺失可以通过减少外泌体中PD-L1的含量以及抑制PD-L1通过外泌体向其他癌细胞转运,从而恢复GC微环境中T细胞的杀伤功能,逆转免疫抑制。
这些结果揭示了LSD1抑制GC中肿瘤免疫的新机制,并可能为以LSD1作为治疗靶点的GC免疫治疗提供新的策略。
文章内容
01
LSD1沉默通过激活GC中的T细胞反应来抑制肿瘤生长
首先通过 TIMER2.0 分析 LSD1 和免疫细胞特征之间的相关性,发现LSD1 与肿瘤浸润性 CD8+ T 细胞呈负相关(图 1a)。使用TCGA数据库的进一步分析显示 LSD1 的 mRNA 与 GC 中的 CD8 和 CD3 mRNA 表达呈负相关(图 1b)。在人GC细胞系BGC-823和MGC 803以及MFC细胞系中敲除(KO)LSD1后接种到 615 只小鼠和 T 细胞缺陷型 BALB/c 裸鼠中,结果显示,在 BALB/c 裸鼠中,MFC LSD1 KO 组的肿瘤重量和体积与 MFC 组相当,而在 MFC LSD1 KO 组中,615 只小鼠的肿瘤几乎完全根除(图 1c 和 d)。这些结果表明 LSD1 可能通过抑制 T 细胞反应来维持肿瘤生长。此外,人类 GC 细胞与抗 CD3/CD28 磁珠激活的 T 细胞共孵育的结果表明,无论 LSD1 是否被敲除,BGC-823 和 MGC-803 细胞在体外都能稳定生长(图 1e),而当LSD1不存在时,这两种癌细胞系更容易被活化的T细胞杀死(图1f)。通过分析图 1c 中 615 只小鼠的剥离肿瘤,发现LSD1 的缺失导致 CD8+ T 细胞浸润增加(图 1g),这与图 1a 中的结果一致。这些结果表明 LSD1 是GC中T细胞反应的抑制因子,LSD1 缺失可能通过在体外和体内促进T细胞杀伤能力显著抑制GC细胞的生长。

图1
02
GC组织样本中LSD1与CD8呈负相关,与PD-L1呈正相关
IHC结果显示LSD1 在 GC 组织中过表达(图 2a 和 2b),与 CD8 呈负相关(图 2c)。癌组织中 LSD1 和 PD-L1 的表达高于相邻组织中的表达(图 2d),并且 PD-L1 与 LSD1 呈正相关(图 2e)。在 TCGA 数据库中,PD-L1 表达也与 GC 中的 LSD1 mRNA 表达呈正相关(图 2f)。这些结果提示 LSD1 和 PD-L1 之间可能存在调节关系。

图2
03
LSD1 的抑制下调 GC 中的 PD-L1
对一组 GC 细胞中的总 PD-L1 和膜 PD-L1 的定量分析结果显示,在不同的 GC 细胞系中总 PD-L1 和膜 PD-L1 的表达明显不均匀(图3a、b)。当 LSD1 被敲除时,PD-L1 mRNA和蛋白表达水平均下调(图3c-f),多泡体的数量减少(图3g和h),同时多泡体标志蛋白TSG101 表达降低(图 3i)。这些结果表明,LSD1缺失可降低PD-L1总表达并且减少PD-L1通过多泡体在细胞外的分泌。
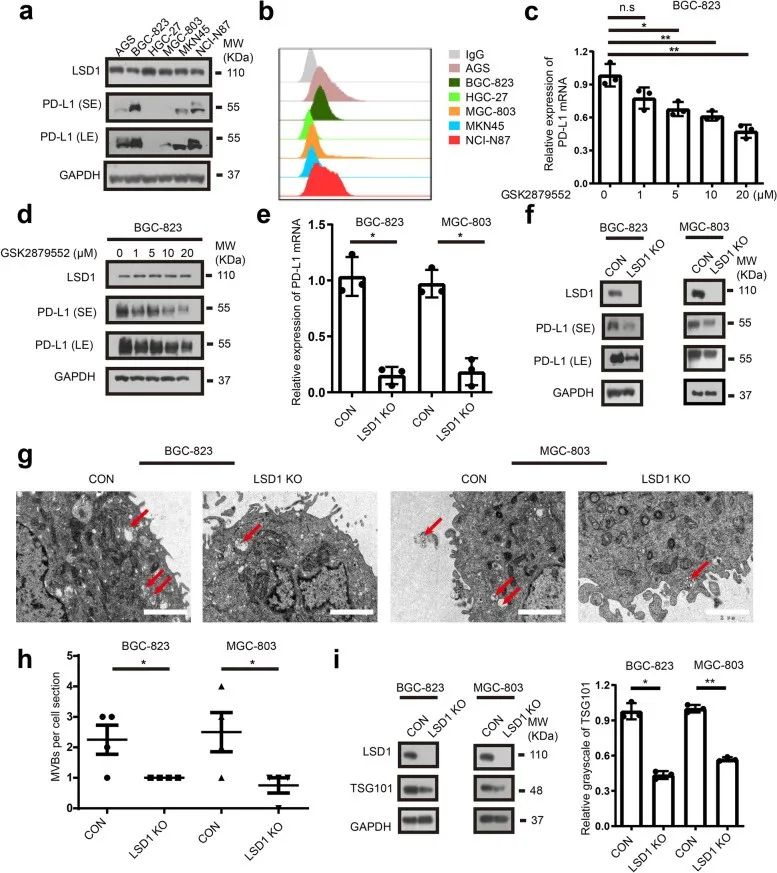
图3
04
LSD1缺失下调GC中的外泌体PD-L1
GC 细胞衍生的外泌体的大小范围为 30 至 200 nm(图 4a 和 b)。使用通过蔗糖梯度离心纯化的外泌体进行的分析,发现外泌体标记 CD63、ALIX 和 CD9 在 20%-40% 蔗糖部分中传播,并且 PD-L1 与这些外泌体标记共定位(图 4c)。PD-L1 被包装到来自 GC 细胞的外泌体中,并且 PD-L1 在GC细胞外泌体中积累(图 4d)。在BGC-823 和 MGC-803 细胞中敲除LSD1后(图 4e、4f),外泌体 PD-L1 减少,表明 LSD1调节外泌体 PD-L1 的积累。此外,从 LSD1 缺失的 BGC-823 和 MGC-803 细胞收集的外泌体也比野生型细胞的外泌体含有更少的 PD-L1(图 4g 和 h)。同时,当 LSD1 被敲除时,GC 细胞衍生的外泌体的浓度降低(图 4i)。抑制外泌体分泌可以诱导 BGC 823 细胞膜 PD-L1 的积累,还可以重新诱导 LSD1 缺失的 BGC-823 细胞膜 PD-L1 的积累(图 4j)。这些结果表明,PD-L1 存在于 GC 细胞衍生的外泌体中,并且 LSD1 敲除减少了总细胞 PD-L1 的量,但保留了膜 PD-L1,以及减少了外泌体分泌和外泌体 PD-L1 的积累。
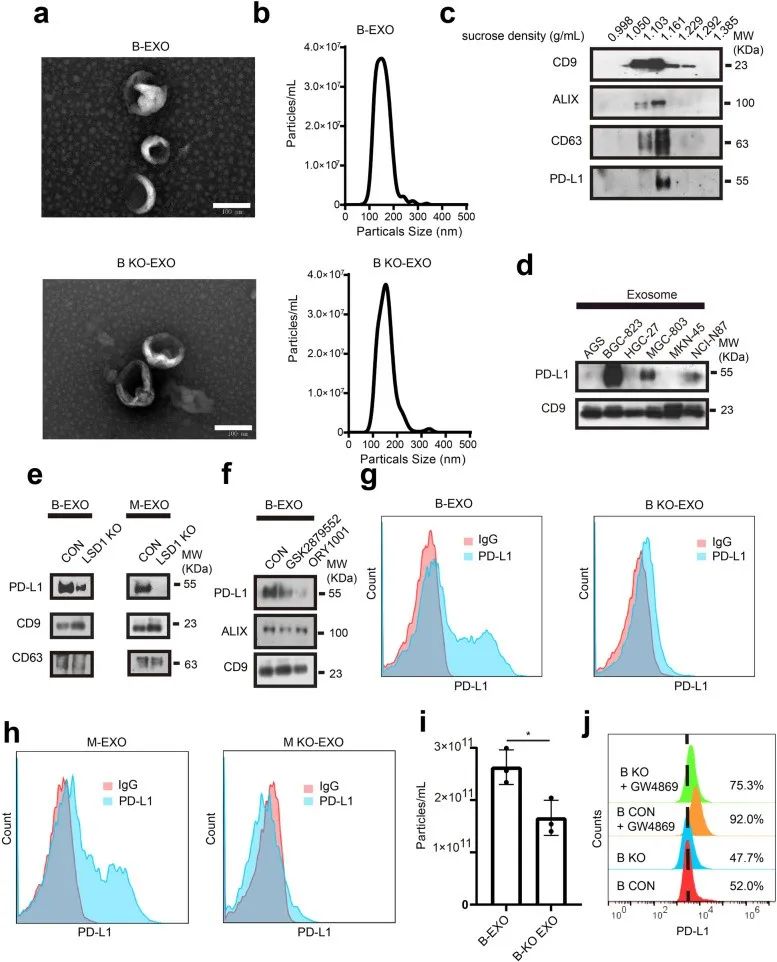
图4
05
LSD1缺失逆转GC衍生的外泌体PD-L1的直接T细胞反应抑制作用
PD-1/PD-L1结合实验显示,用 PKH26 标记的 GC 细胞的外泌体与PD-1结合,当LSD1 缺失时,这种结合可以显著消除(图 5a)。同时,GC 细胞衍生的外泌体可以直接与 T 细胞结合,并且 LSD1的缺失消除了这种相互作用(图 5b)。当用GC细胞外泌体(B-EXO)处理T细胞时,CD8+ T 细胞中的 CD69 有明显的下调,而沉默LSD1的GC细胞外泌体(B KO-EXO)或 PD-L1 抗体或 PD-1 重组体阻断外泌体 PD-L1 的作用挽救了 CD8+ T 细胞中 CD69(CD8+ T 细胞的激活标志物)的抑制表达(图 5c)。在B-EXO存在下T细胞增殖减少,但在 LSD1 被敲除时没有这种情况发生,表明 LSD1的缺失去除了B-EXO的免疫抑制功能(图 5d)。为了进一步证实外泌体可以调节 T 细胞的 GC 细胞杀伤能力,活化的外周血单核细胞(PBMC)与 GC 细胞共培养,并在存在或不存在 LSD1 的情况下用源自GC细胞的外泌体处理。结果表明,B-EXO可以减少 T 细胞杀伤以保持 GC 细胞存活,而B KO-EXO由于 PD-L1 的低表达而对 T 细胞杀伤没有影响(图 5e 和 f)。同时,IL-2(图 5g)、IFN-γ(图 5h)和 TNFα(图 5i)这三种在 T 细胞活化过程中分泌的主要反应性细胞因子也可以被 B-EXO 抑制并被 B KO-EXO 挽救。这些结果一致表明,源自 GC 细胞的外泌体可以直接抑制 TCR 介导的 T 细胞活化,并且该现象取决于由LSD1 调节的外泌体 PD-L1。
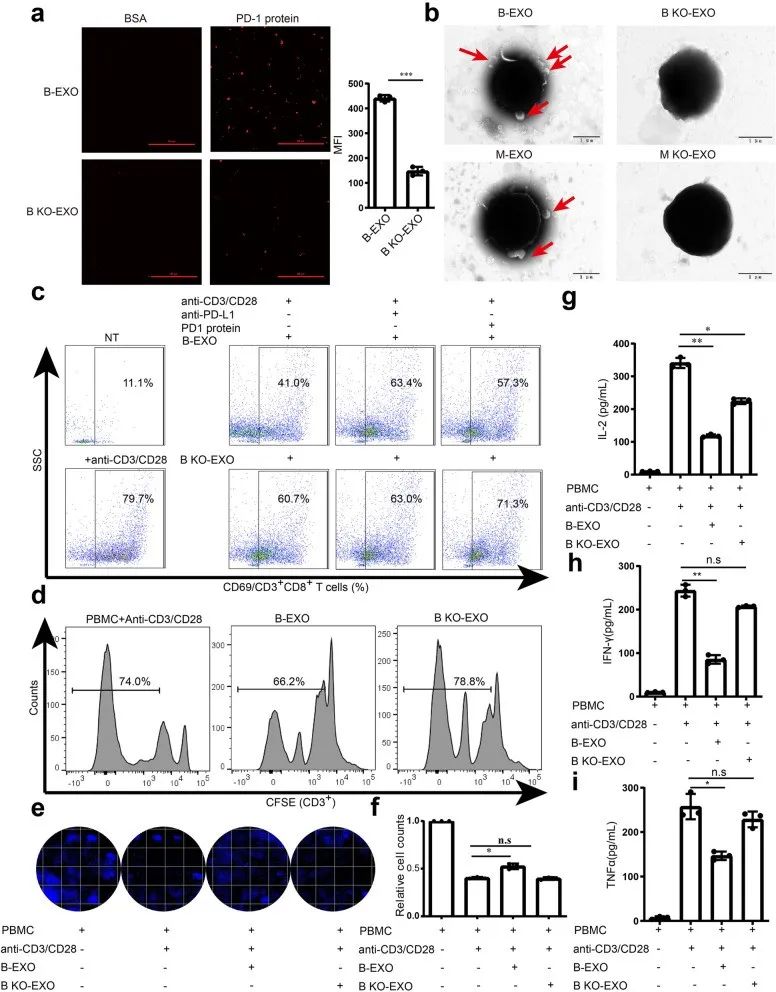
图5
06
LSD1缺失通过影响PD-L1在靶细胞中的表达来逆转GC细胞衍生的外泌体对T细胞反应的抑制作用
将 B-EXO 和 B KO-EXO 用荧光 PD-L1 抗体染色并与GC细胞孵育,结果显示外泌体 PD-L1被转运到目标GC细胞中(图6a)。B-EXO 可以诱导靶细胞膜 PD-L1 的积累,而用 B KO-EXO 处理的GC细胞没有显著的 PD-L1 积累(图 6b),在PD-L1的总表达上也看到了类似的效果(图 6c 和 d)。当用 B-EXO 处理时,PD-1 与细胞表面的结合显著增加,而 PD-1 在用 B KO-EXO 处理的细胞上的结合保持不变(图 6e和f)。因此,当活化的 T 细胞与用 B-EXO 处理的GC细胞共孵育时,CD3+CD8+ T 细胞中 CD69 的表达降低,但在用 B KO-EXO 处理的细胞组中则没有(图 6g)。用 B-EXO 处理的 GC 细胞旨在逃避T细胞杀伤,而 B KO-EXO 对癌细胞的T细胞杀伤敏感性没有显著影响(图 6h)。这些结果表明,外泌体中的 PD-L1 可以转运到其他癌细胞中,从而诱导肿瘤细胞从 T 细胞中免疫逃逸,而 LSD1 缺失降低了 GC 细胞衍生的外泌体的免疫抑制功能,这突出了 LSD1 作为潜在的免疫抑制因子用于肿瘤免疫治疗的潜力。
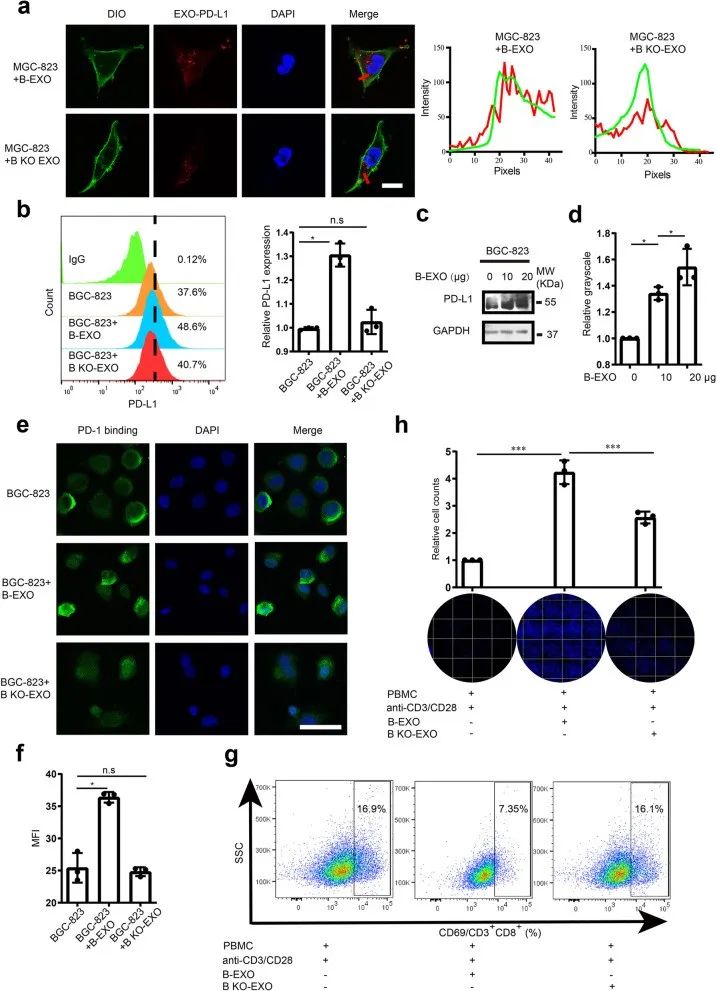
图6
07
来自 LSD1缺失GC 细胞的外泌体通过体内外泌体 PD-L1 促进 T 细胞介导的肿瘤免疫
鉴于 GC 细胞衍生的外泌体在体外抑制了T细胞活化,作者进行了体内实验以验证这一结论。结果发现,LSD1 的缺失显著抑制了小鼠的肿瘤生长。注射来自小鼠前胃癌细胞(MFC)的外泌体的小鼠(MFC+CON EXO 组)的肿瘤明显大于未治疗肿瘤的小鼠(MFC 组),而注射了来自 MFC LSD1 KO 细胞的外泌体的小鼠(MFC+KO EXO 组)的肿瘤比这两组小得多(图 7a-c)。此外,当来自 MFC 和 MFC LSD1 KO的外泌体与PD-1一起孵育以阻断外泌体 PD-L1(MFC+CON EXO+PD-1 组和 MFC+KO EXO+PD-1 组)时,MFC+CON EXO+PD-1 组、MFC+KO EXO+PD-1 组和 MFC+KO EXO组的肿瘤体积和重量没有显著差异(图 7a-c)。与 MFC 组相比,MFC LSD1 KO 组中 CD8+ T 细胞的比例显着增加,而 LSD1 KO 细胞衍生的外泌体也促进了CD8+ T细胞的比例(图 7d)。另一方面,当外泌体 PD-L1 被 PD-1 重组体阻断时,MFC+CON EXO+PD-1 组中 CD8+ T 细胞的比例高于 MFC+CON EXO 组(图 7d)。同时,MFC+KO EXO 和 MFC+KO EXO+PD-1 组之间 CD8+ T 细胞的比例没有显着差异(图 7d)。对于这些肿瘤中的肿瘤浸润性 CD3 和 CD8 表达(图 7e 和 f)以及细胞因子 IL-2 和 IFN-γ 的表达(图 7g 和 7h)也获得了趋势一致的结果。此外,携带 MFC LSD1 KO 细胞的小鼠血浆中外泌体 PD-L1 的表达远低于携带 MFC 细胞的小鼠血浆中的表达(图 7i),这表明 LSD1 具有通过外泌体PD-L1调节全局免疫反应的潜力。总的来说,这些结果表明 LSD1 缺失可以抑制GC小鼠模型中 MFC 细胞的增殖。同时,在依赖供体细胞中存在 LSD1 的同时,外泌体可以调节 MFC 细胞增殖,其作用取决于外泌体 PD-L1 介导的体内 T 细胞免疫。
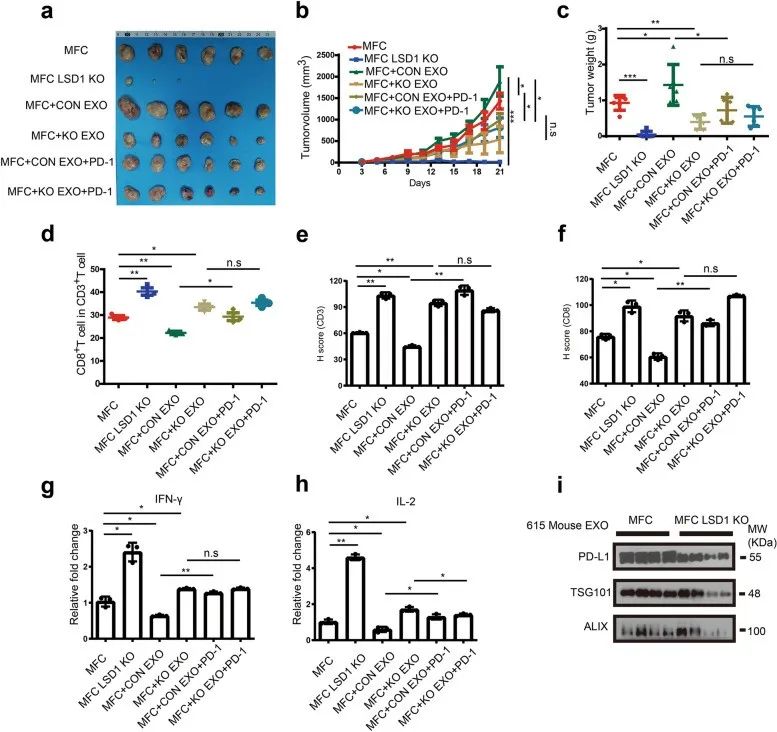
图7
小结
该项研究发现 LSD1 缺失通过减少外泌体中 PD-L1 的积累来增强T细胞活性,从而抑制肿瘤生长。更重要的是,使用外泌体作为载体,LSD1 通过外泌体 PD-L1 阻碍其它癌细胞的 T细胞反应,而LSD1的缺失则恢复了T细胞功能。这些发现揭示了LSD1通过外泌体PD-L1调节T细胞免疫的新途径,并为以LSD1为靶点的GC免疫治疗提供了新的策略。

2022年度国自然医学部国自然40大科研热点的中标数统计如下:
2022热点 | 2022中标数 | 2022热点 | 2022中标数 |
免疫调控 | 907 | 中性粒细胞 | 112 |
巨噬细胞 | 591 | 反馈回路 | 104 |
线粒体 | 491 | 乳酸化 | 104 |
血管功能 | 487 | 可变剪接 | 71 |
外泌体 | 470 | AI机器学习 | 67 |
自噬 | 404 | 类器官 | 67 |
铁死亡 | 337 | 炎症小体 | 62 |
干细胞 | 329 | 染色质重塑 | 58 |
代谢重编程 | 325 | 单细胞测序 | 54 |
m6A/m5C/m7G | 320 | 糖基化 | 50 |
泛素化 | 225 | 低氧缺氧 | 50 |
circRNA | 221 | 相分离 | 50 |
lncRNA | 204 | 泛凋亡PANoptosis | 42 |
细胞焦亡 | 175 | 细胞衰老 | 37 |
组蛋白 | 171 | 胞葬 | 33 |
肠道菌群 | 133 | CRISPR | 33 |
乙酰化 | 125 | 增强子 | 29 |
内质网 | 125 | 精氨酸甲基化 | 25 |
转录调控 | 112 | 迁移体 | 8 |
糖酵解 | 112 | 血管拟态 | 8 |
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)