2023-07-18

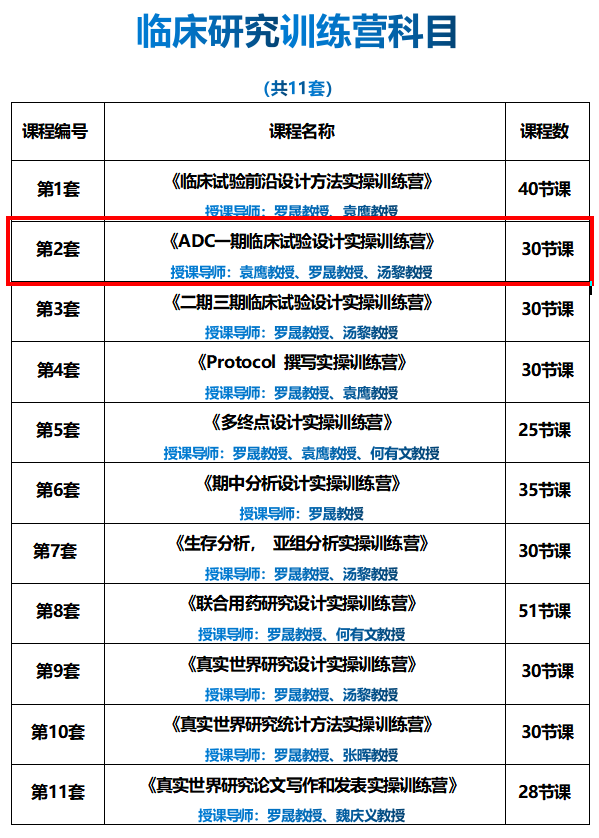
本期内容摘自《ADC一期研究实操训练营》模块二 | 课程8、9《ADC一期研究设计要点》,美国杜克大学医学中心生物统计系正教授罗晟教授、美国圣犹达儿童研究医院生物统计系副教授汤黎教授,特邀临床PI复旦大学附属肿瘤医院张剑教授共同授课。
课程内容:
课程时长:80分钟
如何确定首次临床试验起始剂量?

教授推荐阅读文献:《Good Review Practice: Clinical Review of Investigational New Drug Applications》,指南中对于如何探索MTD的方法,定义及要点都有非常详尽的描述,包含大家常问的一些问题,如:起始剂量如何拟定,Dose的间距如何设置等。


指南中,对于首次临床试验起始剂量拟定要求的相关描述:


ADC药物的起始剂量如何拟定?
ADC药物的靶向结合、吸收、分布特征与单抗相似,药效和毒性主要来自于小分子化合物。因此,临床起始剂量的拟定可采用细胞毒药物起始剂量的拟定方法,按照体表面积计算,基于猴HNSTD的1/6和啮齿动物STD10的1/10进行临床起始剂量的拟定。按照千克体重计算,采用猴或大鼠NOAEL的1/10估算的起始剂量也是可行的,似乎更为保守、安全。
1)某ADC药物X的SD大鼠6周重复给药(Q3W*3,10~100mg/kg)毒理研究结果显示:10%大鼠出现严重毒性反应的剂量(STD10)为100mg/kg;基于大鼠STD10的1/10通过体表面积换算,得到某ADC药物X的人体剂量为1.61mg/kg;
2)某ADC药物X的恒河猴6周重复给药(Q3W*3,10~50mg/kg)毒理研究结果显示:某ADC药物X在恒河猴中最高非严重毒性剂量(HNSTD)为25mg/kg,基于猴HNSTD的1/12通过体表面积换算,得到某ADC药物X的人体剂量未0.67mg/kg;
3)某ADC药物X携带毒素的SD大鼠4周重复给药(QW*5,0.1~0.6/1.0mg/kg)毒理研究结果显示,毒素在大鼠中的STD10为0.6mg/kg,基于该STD10的1/10通过体表面积和分子量换算,得到某ADC药物X的人体剂量为2.05mg/kg;
4)某ADC药物X携带毒素的食蟹猴6周重复给药(Q3W*3,0.8mg/kg)毒理研究结果显示,毒素在食蟹猴中的HNSTD为0.8mg/kg,基于该HNSTD的1/6通过体表面积和分子量换算,得到某ADC药物X的人体剂量为3.04mg/kg。
综合上述计算结果,考虑临床给药的便利性,某ADC药物X在首次人体研究中的起始剂量拟定为:0.6mg/kg。
为何上述第二项按照1/12进行换算,而不是1/10?张剑教授在课程中给予了解答:

大家非常熟悉的DS-8201一期研究,在其方案中我们看到相关描述如下:

根据HNSTD的1/6通过体表面积和分子量换算,得到的人体剂量为1.6mg/kg,但DS-8201最终进入一期的起始剂量是1/12,即:0.8mg/kg,该剂量的选定是基于包括ADC药物延迟毒性等综合因素的考量。

















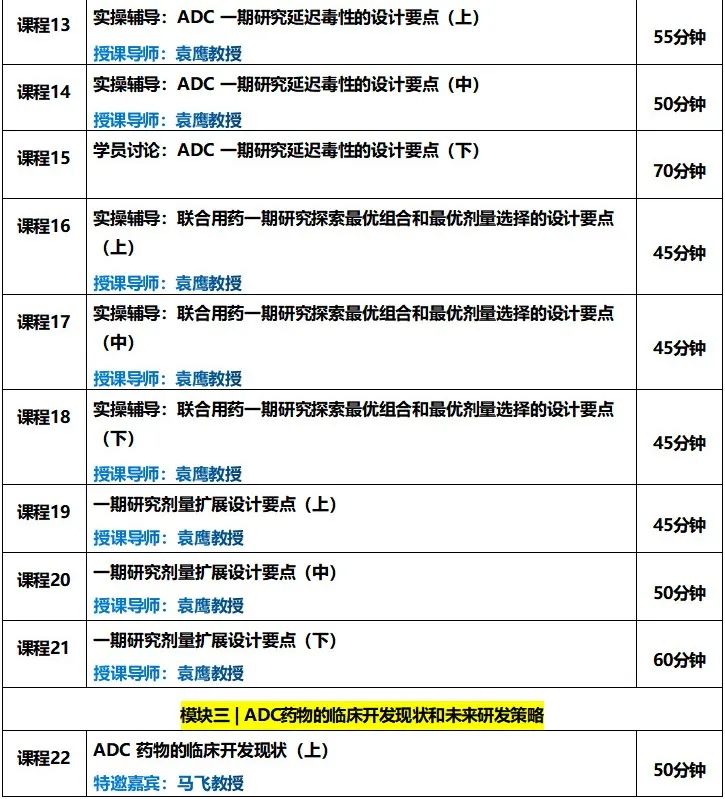


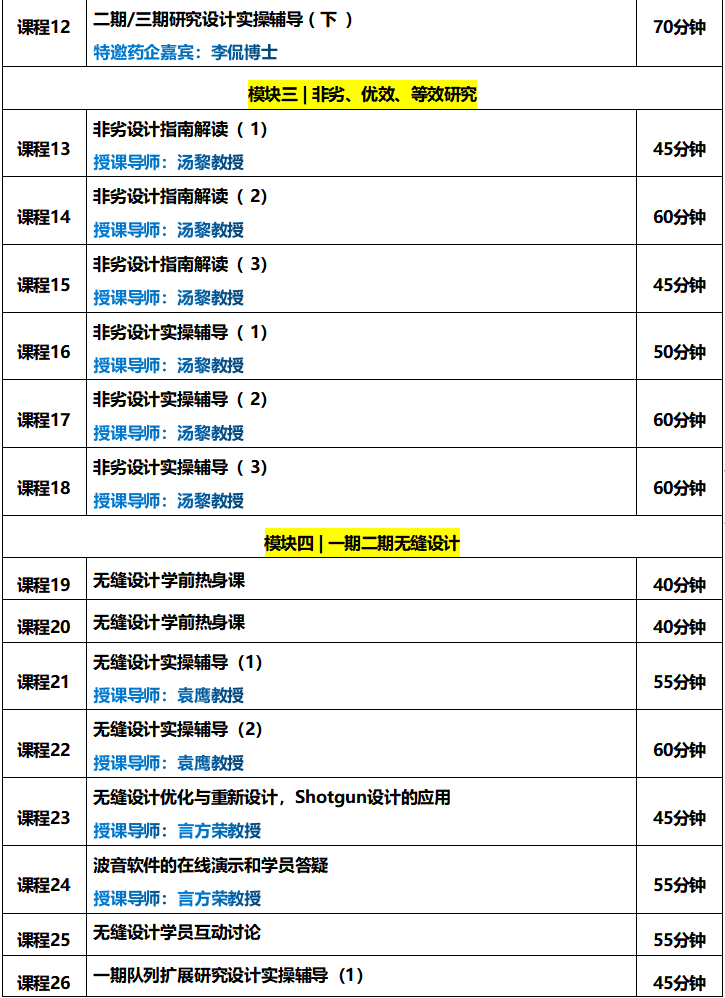











训练营课程持续更新中......
添加小编微信

百度浏览 来源 : 国际临研
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。




发表评论
注册或登后即可发表评论
登录注册
全部评论(0)