
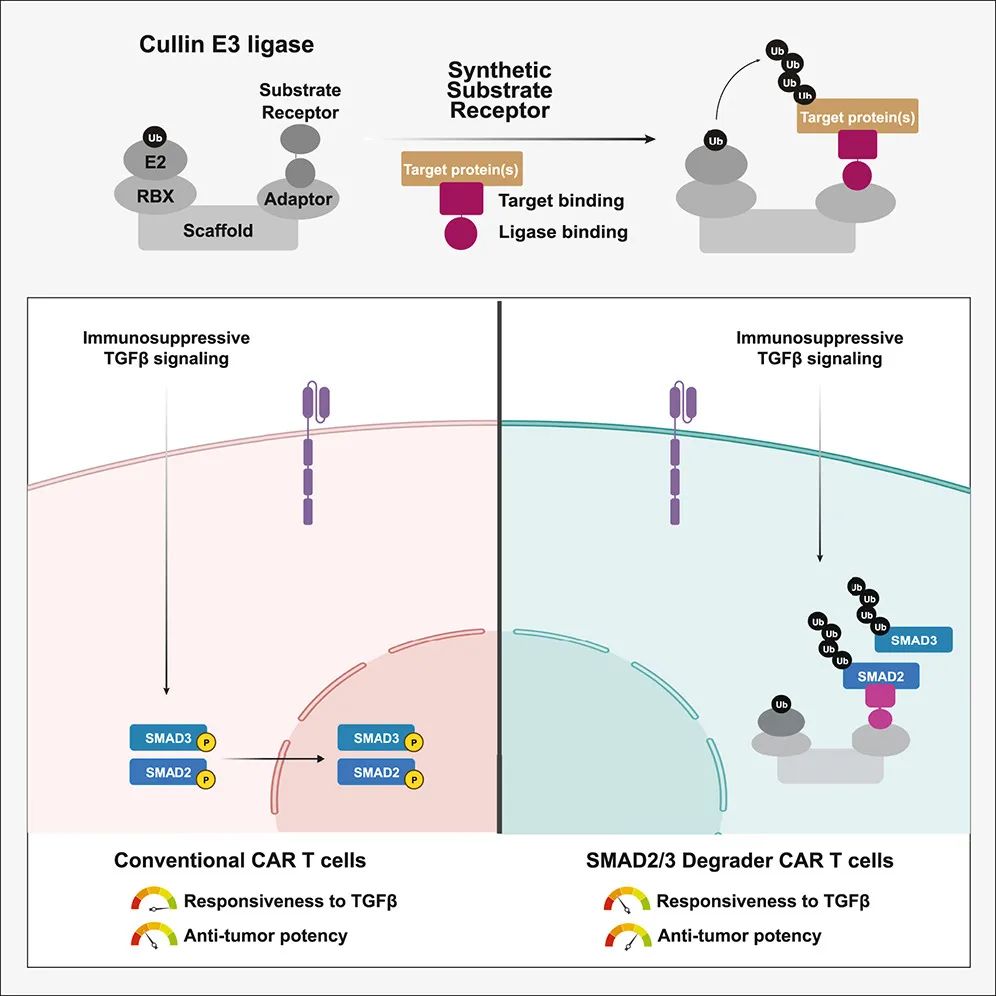
过去十年里,以CAR-T为代表的细胞疗法改变了肿瘤治疗领域的格局,尤其是在血液类肿瘤中展现出传统疗法无可比拟的治疗效果,为患者带来了新的希望。为了提高细胞治疗效果,研究人员通过CRISPR-Cas9筛选识别限制T细胞抗肿瘤效力的基因,目前已有多项CRISPR基因编辑修饰的T细胞疗法进入临床试验,然而,许多限制T细胞抗肿瘤效力的基因在实际应用中仍然具有挑战性。首先,与血液系统恶性肿瘤相关的基因(例如TET2和DNMT3A)不可逆敲除可能会增加工程细胞转化的风险。其次,限制免疫细胞功能的核心通路通常在遗传上是冗余的,因此很难在不诱导多次基因组编辑和DNA双链断裂的情况下进行靶向。第三,负向调控基因通常也发挥着预防过度刺激的有益作用。因此,需要创新技术来对限制细胞免疫疗法的蛋白质进行条件性、多特异性调控,而不必靶向与癌症相关的基因位点。2023年11月20日,哈佛医学院的研究人员在 Cell 子刊 Cell Chemical Biology 上发表了题为:Genetic retargeting of E3 ligases to enhance CAR T cell therapy 的研究论文。该研究借鉴了蛋白靶向降解嵌合体(PROTAC),开发了双功能融合“降解”蛋白,连接一个或多个目标蛋白和E3连接酶复合物,以加强目标蛋白泛素化和降解。通过诱导降解转基因表达或小分子依赖的E3招募,开发了条件性降解策略。并使用该策略来靶向降解转录因子SMAD2/SMAD3,从而阻断SMAD依赖的TGFβ信号,SMAD降解的CAR-T细胞表现出增强的体内抗肿瘤效力。这项表明,这是一个临床上适用的合成生物学平台,可以重编程E3连接酶的目标特异性,用于条件性、多特异性内源性蛋白降解,具有包括增强CAR-T细胞疗法效力在内的有前途的应用。CAR-T细胞疗法是癌症治疗的新突破。然而,治疗失败往往是由CAR-T细胞功能障碍引起的,需要更多的方法来克服限制免疫细胞抗肿瘤效力的抑制信号。除了在DNA/RNA水平敲除或干扰这些抑制免疫细胞抗肿瘤效力的基因外,可诱导的蛋白-蛋白相互作用控制内源性蛋白质丰度是重连细胞电路和靶向抑制细胞免疫疗法通路的另一种方法。事实上,第一个蛋白靶向降解嵌合体(PROTAC)部分是基于肽的双功能分子,桥接E3泛素连接酶和靶蛋白,从而诱导靶蛋白泛素化和降解。这种诱导靶蛋白降解的E3招募策略已被用于诱导模型系统中GFP标记的融合蛋白的降解,以及在人细胞中靶向内源性蛋白质,例如β-catenin白和PCNA。虽然这种双功能融合蛋白正在成为经过验证的实验工具,但还没有被用于基因和细胞疗法。在这项研究中,研究团队报告了全人源序列E3招募融合蛋白的开发,称为合成底物受体(SySR),以诱导限制CAR-T细胞效力的蛋白组的条件性、多特异性降解。研究团队优化了多种广泛表达的E3连接酶的结合域,使多种细胞类型的有效靶标降解率>90%。对于合成电路应用,该研究探索了两种策略,即通过诱导启动子和来那度胺诱导的靶向CRL4CRBN的条件性靶向降解。为了证明细胞治疗应用的概念,研究团队开发了靶向多个SMAD家族转录因子的SySR,这些转录因子加强了T细胞抑制性TGF-β信号。结果显示,对SMAD的降解增强了CAR-T细胞的增殖和抗肿瘤功能。这些结果表明,合成底物受体(SySR)是一个可推广和临床上适用的平台,用于降解免疫细胞的抑制性蛋白组,从而增强下一代细胞免疫疗法。doi.org/10.1016/j.chembiol.2023.10.024
医微客一站式科研服务平台,致力于服务医院和企业,协助医生解决科研上的痛点,提升临床科研水平,为企业提供医学写作、医学编辑、科研培训和学术传播等策略支持。
科研资讯(站内):
百度浏览
来源 : 生物世界
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。







发表评论
注册或登后即可发表评论
登录注册
全部评论(0)