肌萎缩侧索硬化症(ALS,俗称渐冻症)和额颞叶痴呆(FTD)是两种进行性、成人发病的神经退行性疾病,分别由运动皮层和脊髓中的运动神经元以及额叶和颞叶中的皮层神经元的细胞死亡引起。
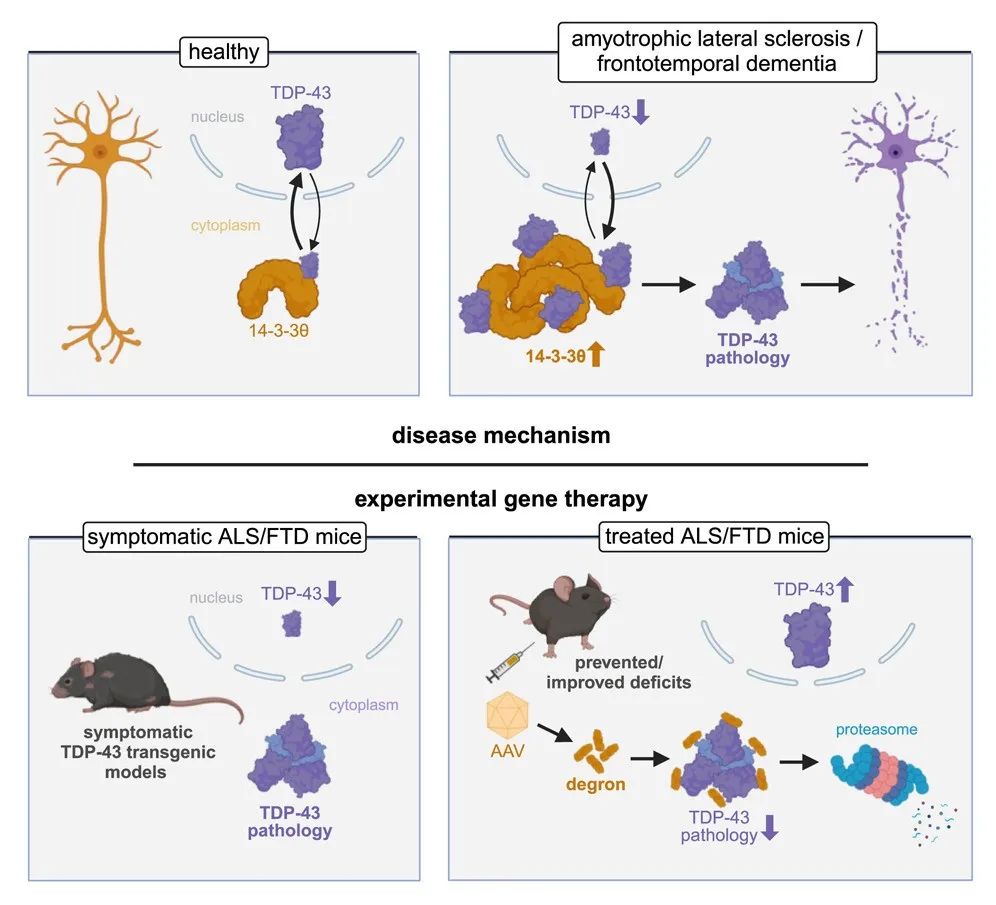
ALS 是一种运动神经元疾病(MND),会导致大脑和脊柱与肌肉沟通的神经元逐渐丧失。在早期阶段,患者会出现肌肉无力,但随着疾病的进展,他们逐渐失去独立行走、说话、吞咽和呼吸的能力。大多数 ALS 患者在诊断后两到五年内死亡。虽然有一种基因疗法有望治疗一种家族性 ALS,但对于占所有病例 90% 的散发性 ALS,几乎没有可用的治疗方法。其中,最有效的只能将患者的生命延长最多五个月。所有这些都需要频繁服用,有些还伴有难以应对的副作用。FTD 是一种较为罕见的痴呆症,但它是 65 岁以下人群中第二常见痴呆症。该病并不总是有明显的身体症状,但它会导致认知能力下降,并伴有行为症状,包括焦虑、失去抑制、性格改变和判断力受损。患者确诊后可能存活 10 多年,但最终是致命的。目前 FTD 尚无治疗方法。在健康的神经元中,核 TAR 结合蛋白 43(TDP-43)是自然产生的,对其健康功能很重要。然而,TDP-43 在合成后可能会被修饰,导致其在细胞的错误部位积累和聚集,从而阻止它们正常工作。这些积聚与毁灭性的神经退行性疾病有关,例如 ALS、FTD 等。已有研究发现,两种疾病的神经病理学特征是核 TAR 结合蛋白 43(TDP-43)的细胞质沉积。因此,TDP-43 的细胞质重新定位是 ALS/FTD 发病机制中的关键事件,但其潜在机制仍不清楚。近日,来自澳大利亚麦考瑞大学的神经研究人员发现,14-3-3θ 蛋白和 TDP-43 之间存在相互作用,其调节后者的细胞质重定位。在具有 TDP-43 病理学的散发性 ALS 和 FTD 中,14-3-3θ 蛋白水平也会升高。致病性 TDP-43 与 14-3-3θ 的相互作用增加,导致 TDP-43 在细胞质中积累、不溶、磷酸化和断裂,类似于疾病的病理变化。14-3-3θ 蛋白属于 14-3-3 蛋白家族,已知该家族通过与其他蛋白结合来调节其他蛋白,并且它们在各种细胞过程中发挥作用,包括信号传导、生存和细胞分化。Annika van Hummel 博士、Yazi Ke 教授和 Lars Ittner 教授(来源:麦考瑞大学)利用 14-3-3θ 对致病性 TDP-43 增加的亲和力,研究人员设计了一种针对 TDP-43 病理学的基因治疗载体,该载体减轻了表达突变或非突变 TDP-43 的不同 ALS/FTD 小鼠模型的功能缺陷和神经变性,包括在治疗时已经出现症状的情况。相关研究以:Targeting 14-3-3θ-mediated TDP-43 pathology in amyotrophic lateral sclerosis and frontotemporal dementia mice 为题,发表在了 Neuron 期刊上。这项研究的通讯作者是麦考瑞大学痴呆症研究中心主任和医学、健康与人文科学学院生物医学科学系教授 Lars Ittner,他在理解阿尔茨海默病和额颞叶痴呆的基本病理机制方面作出了重大贡献,并确定了这些疾病药物开发的几个新靶点。在过去的 15 年里,Lars Ittner 和他的团队一直在研究病理性 TDP-43 的积累。“这两种蛋白质相互作用,导致这些蛋白质在细胞中堆积。由此,我们能够分离出控制这种相互作用的短肽,并基于此开发了名为 CTx1000 的单剂量基因疗法。”CTx1000 针对的是大脑和脊髓细胞中 TDP-43 蛋白的病理性积聚,这种蛋白与 ALS、FTD 和其他形式的痴呆症有关。“当我们在实验室中使用它时,它会溶解堆积物,标记 TDP-43 蛋白以供人体回收,并防止新蛋白的形成。重要的是,CTx1000 仅针对病理性 TDP-43,从而允许产生健康版本的蛋白质并不受阻碍地发挥其作用。”Lars Ittner 表示,CTx1000 在他们的研究中没有显示出任何副作用。该论文的主要作者 Yazi Ke 博士指出,在实验室条件下,CTx1000 即使在晚期阶段也能阻止 ALS 和 FTD 的进展,并解决与 FTD 相关的行为症状。尽管 CTx1000 主要针对 ALS 和 FTD 进行测试,但它也有望治疗更常见的痴呆症,例如阿尔茨海默病。通过靶向和清除病理性 TDP-43,该疗法有可能减轻症状并阻止目前缺乏有效治疗方案的几种神经退行性疾病的进展。该疗法由麦考瑞大学的一家衍生公司 Celosia Therapeutics 推进。该公司成立于 2022 年,致力于开发针对神经退行性疾病的疗法。Lars Ittner 正是该公司的创始人,他希望能够在两年内将 CTx1000 推进到人体临床试验阶段,他们已经从 FightMND 获得了 120 万美元的临床前资助来协助这一过程。然而,进行人体试验的估计成本为 2200 万美元,研究团队正在积极寻求投资来支持这一关键阶段。该公司的另外一位创始人 Roger Chung 系麦考瑞大学医学、健康与人类科学学院神经生物学和神经化学教授兼副院长。其领导研究项目近 20 年,开发了用于神经保护和神经再生的肽疗法(已授权给一家 ASX 上市公司)。他的研究项目在生物化学、细胞和分子生物学、蛋白质组学和疾病动物模型方面拥有广泛的专业知识。1.www.genengnews.com/topics/genome-editing/gene-therapy-in-mice-holds-promise-for-als-and-dementia/2.doi.org/10.1016/j.neuron.2024.01.0223.lighthouse.mq.edu.au/article/february-2024/new-genetic-therapy-could-be-a-gamechanger-for-mnd-and-frontotemporal-dementia
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。








发表评论
注册或登后即可发表评论
登录注册
全部评论(0)