2022-06-14 来源 : 抗体密码 ,作者抗体密码-大脸猫
在肿瘤治疗领域,罗氏也以其坚实的创新在不断的拓宽治疗领域,从原来的乳腺癌治疗(Herceptin,Perjeta和Phesgo,以及靶向HER2的ADC药物Kadcgyla和免疫检查点抑制剂tecentriq),逐渐伸到血液瘤领域(CD20-TCB,GPRC5D,HLA-A2-WT/CD3,CD19/CD28和CD19/4-1BBL等), 特别是近日其CD20/CD3双特异抗体的获批,为其迈进血液瘤领域打下了坚实的基础。本篇文章我们通过本次ASCO会议,来了解一下罗氏在肿瘤中的全方位布局。

进一步探索的乳腺癌领域
目前罗氏已经有多款药物获批用于乳腺癌的治疗,如靶向HER2的单克隆抗体Herceptin,Perjeta(pertuzumab/帕妥珠单抗)和Phesgo(帕妥珠单抗+赫赛汀固定剂量皮下制剂),以及靶向HER2的ADC药物Kadcgyla(HER2 IgG1曲妥珠单抗Trastuzumab和微管剂DM1偶联)。另外免疫检查点抑制剂tecentriq(阿特珠单抗靶向PD-L1的抗体)于2019年3月被FDA批准与白蛋白紫杉醇联合用于PD-L1阳性三阴乳腺癌一线治疗,Tecentriq因此也成为首个斩获三阴乳腺癌一线疗法的PD-(L)1单抗,这也是三阴乳腺癌迎来首个肿瘤免疫疗法。
除了上述已经获批的药物,罗氏还在双特异抗体和小分子药物方面积极布局乳腺癌的治疗,如靶向HER2/CD3的双特异抗体,其主要是用于HER2阳性的乳腺癌的治疗,通过桥接并激活T细胞对肿瘤细胞进行杀伤。在小分子领域,目前主要有两款药物在临床探索中,inavolisib和giredestrant。其中inavolisib是一款靶向PI3Kα突变体的选择性抑制剂,研究表明,inavolisib不但可以阻断PI3Kα的活性,而且可以促进PI3Kα突变体p110α催化亚基的降解,inavolisib与突变体的结合让PI3Kα更不稳定并且更容易被降解。giredestrant是一种口服新一代SERD,旨在完全阻断ER信号,研究表明该药具有强大的受体占有率。雌激素通过附着在ER上促进HR阳性乳腺癌细胞生长。giredestrant通过阻断该受体来阻止雌激素的作用,并在此过程中导致受体降解。
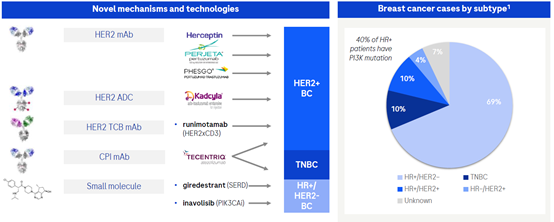

全面布局血液瘤
罗氏在血液瘤的布局几乎覆盖了所有肿瘤,包括DLBCL,FL,MCL,MM,MDS,AML和CLL,分子设计上包含了双特异抗体(1+1和2+1型TCB),融合蛋白,单克隆抗体,小分子,ADC和糖基化修饰的单克隆抗体。其中TCB双特异抗体包括CD20/CD3,GPRC5D/CD3,HLA-A2-WT/CD3以及CD19/CD28等,融合蛋白包括新披露的CD19/4-1BBL。

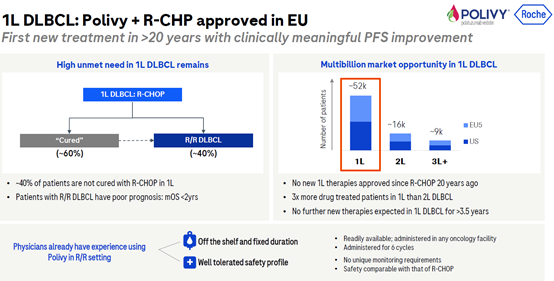
2.1 Polivy+ R-CHP一线治疗DLBCL 20年来新突破
弥漫性大B细胞淋巴瘤是一种侵袭性(快速生长)的非霍奇金淋巴瘤。虽然其通常对一线治疗有应答,但出现复发或患有难治性疾病时,挽救性治疗方案有限且生存期短。目前一线DLBCL的治疗方案是R-CHOP化疗(R:利妥昔单抗,C:环磷酰胺,H:多柔比星,O:长春新碱,P:泼尼松龙),该方案可以治疗约60%的病人,但是有40%的病人会复发,并且这些病人复发后的生存期平均低于两年。
今年5月27日,欧盟委员会(EC)已批准Polivy(polatuzumab vedotin)联合利妥昔单抗加环磷酰胺、阿霉素和泼尼松(R-CHP)治疗既往未治疗的弥漫性大B细胞淋巴瘤(DLBCL)成人患者。EC批准是基于国际III期、随机、双盲、安慰剂对照研究POLARIX(GO39942;NCT03274492)的结果,所有患者均接受了至少24个月的随访,中位随访时间为28.2个月。研究结果显示,与一线DLBCL中的R-CHOP相比,Polivy加R-CHP的疾病恶化或死亡风险降低27%(危险比[HR]0.73;95%置信区间[CI]:0.57-0.95;P<0.0177),安全性方面两者相当。
并且在亚洲组临床中,其两年的PFS也优于传统的R-CHOP疗法(74.2%VS66.5%)。

2.2 CD20/CD3双特异抗体疗法
在DLBCL治疗方面,除了刚刚获批的Polivy+R-CHP疗法,罗氏还有两款正在临床开发中的CD20/CD3双特异抗体疗法Mosunetuzumab(Mosun)和glofitamab(G)。这两款抗体虽然作用靶点相同,但是其结构上有所差异,其中Mosun为1+1不对称双特异抗体,G为2+1不对称双特异抗体。其中有两款疗法已经位于Ⅲ期临床:Glofit+ GemOx (STARGLO) 2线以上治疗DLBCL和Polivy + mosun 2线以上治疗DLBCL。
除了用于DLBCL的治疗,两款抗体同时也在临床中测试治疗FL的疗效。其中Mosun单药治疗已于2022年6月8日,获得欧盟委员会有条件的上市许可,用于成年患者之前至少接受过两次全身治疗的患有复发性或难治性(R/R)滤泡性淋巴瘤(FL)。关于其作用机制及临床结果这里不再赘述,详见《全面:解读首个上市CD20xCD3双抗作用机制》,另外,mosun + lenalidomide 2线以上治疗FL也已经进入Ⅲ期临床。

2.3 glofitamab(G)
在本次ASCO会议上,罗氏也披露了glofitamab单药在R/R DLBCL治疗中的二期临床结果。Glofitamab的用药策略如下图所示,每21天为一周期,Day1利用obinutuzumab(CD20单克隆抗体)治疗,降低肿瘤的负荷,Day8给药2.5mg,Day15给药10mg,后续每个周期的Day1进行全剂量给药30mg,D20单抗前处理以及剂量递升是为了防止CRS的发生。

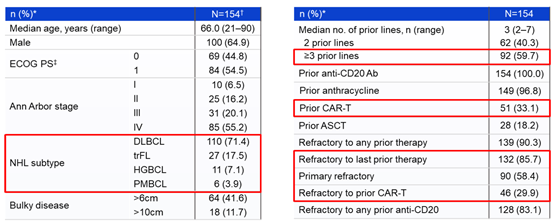
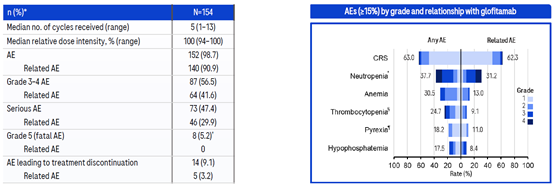
Ⅱ期临床入组病人情况如下:154位病人的平均接受了2线治疗,其中59.7%的病人接受大于等于3线治疗,所有病人在接受glofitamab治疗前都接受过CD20靶向治疗,并且有51%的病人接受过CAR-T治疗。
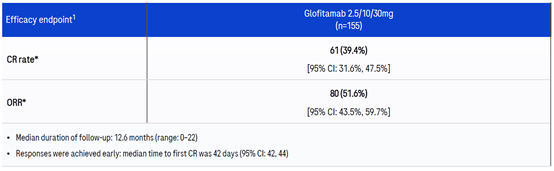
Glofitamab治疗后并平均随访12.6个月后,155位病人的完全缓解率CR为39.4%,客观缓解率ORR为51.6%。
截止日期前,Glofitamab治疗的中位PFS为4.9个月,中位OS为11.5个月,其中一年的OS为49.8%

安全性方面,Glofitamab治疗的不良反应主要是CRS(63%),其中多数为1-2级,并且CRS多数出现在第一个疗程的首次给药,随着给药的次数的增多,CRS发生概率逐渐降低。
2.4 GPRC5D/CD3双特异抗体
在今年ASCO会议上强生展示了其GPRC5D/CD3双特异抗体Talquetamab在两个剂量组的疗效,405μg/kg剂量组的ORR为70%(21/30),VGPRs或者更好为57%;而在800μg/kg剂量组,ORR为64%(28/44),VGPRs或者更好为52%,目前的疗效充分证明的了GPRC5D/CD3在RRMM中的疗效。
与强生不同,罗氏2+1 型GPRC5D/CD3双特异抗体中含有两个靶向GPRC5D的结构域,与1+1型双抗体相比,2+1型GPRC5D/CD3双抗无论是在激活T细胞还是在肿瘤杀伤中都具有更强劲的效果。
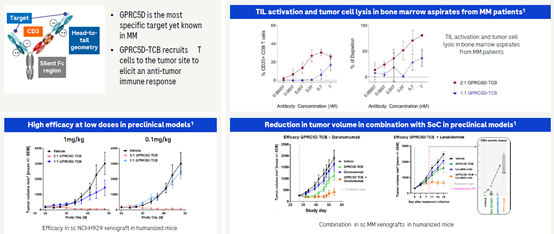
初步的Ⅰ期临床疗效表明,在已经评估的34位病人中,有68%的病人具有客观缓解,其中50%的病人为VGPR或者更好。

2.5 CD19/4-1BBL双抗联合CD20-TCB
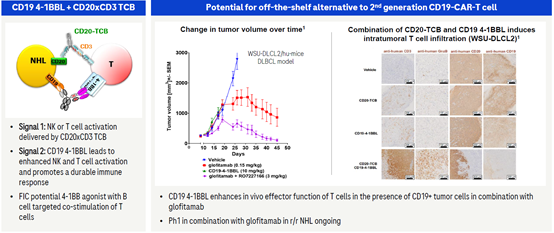
CD20-TCB可以通过信号1激活T细胞并通过CD20将T细胞靶向肿瘤细胞并对肿瘤细胞进行杀伤。但是越来越多的研究表明,在肿瘤的治疗中,T细胞的快速强力的激活会导致T细胞很快耗竭,从而无法维持T细胞的活力对肿瘤细胞进行杀伤,并最终导致肿瘤的复发。
罗氏开发的CD19/4-1BBL双功能抗体,融合了可以结合并激活4-1BB的4-1BBL。该抗体一方面可以通过CD19定位到B细胞表面,另外一方面,4-1BBL可以与被CD20-TCB激活的T细胞上的4-1BB结合,从而维持并增强T细胞的活力。临床前研究证明,两个双特异抗体联合用药效果远优于单个CD20-TCB的效果,并且可以增加T细胞对肿瘤细胞的浸润。两个双抗联合在一定程度上模仿了二代CAR-T的功能,但是与CAR-T疗法相比,该疗法为现货性药物,不仅方便而且成本更低,目前该疗法已经在Ⅰ期临床中。
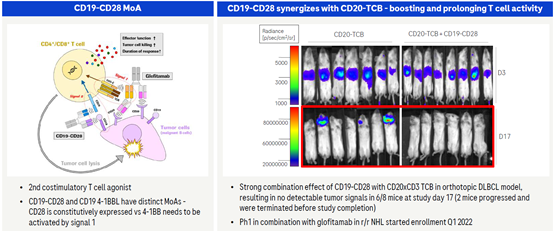
2.6 CD19/CD28双抗联合CD20-TCB
关于CD28作为第二信号激活T细胞的原理之前我们已经介绍了很多,这里不再赘述。CD19/CD28双抗和CD20-TCB双抗联合用药和再生元的CD3双抗/CD28双抗联合用药类似,其可以用CD20和CD19将T细胞共定位到肿瘤细胞,然后利用信号1和信号2激活并维持T细胞的活性,促进T细胞的增殖,从而防止T细胞的耗竭,使得T细胞可以对肿瘤细胞进行持续的杀伤,最终到达治疗的目的,目前该疗法在Ⅰ期临床中,并于今年第一季度开始入组患者。
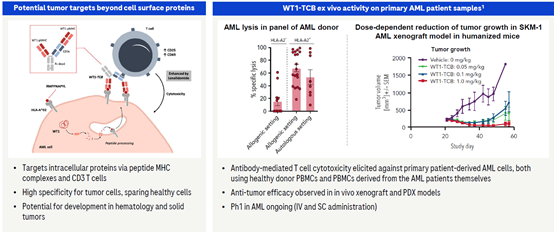
2.7 HLA-A2 WT1/CD3(RG6007)
RG6007是靶向HLA-A2 WT1/CD3的双特异抗体,结构上同样采用了2+1形式。研究表明,肾母细胞瘤蛋白wt1抗原在白血病以及乳腺癌、甲状腺癌等癌组织中均有高表达或异常表达(包括过度表达、缺失、突变以及易位),在不同肿瘤的发生、发展中起着重要作用。wt1抗原多肽能诱导特异性的细胞毒性t淋巴细胞(ctl)反应,体内、体外实验均已取得良好的抗肿瘤作用。wt1肽和hla-a2分子形成复合物常表达于wt1阳性的肿瘤细胞,并且在体外的研究中,HLA-A2 WT1/CD3双抗也展现了良好的特异性和有效性,目前该双特异抗体已经进入临床Ⅰ期,用于治疗AML。
其它早期双特异抗体管线
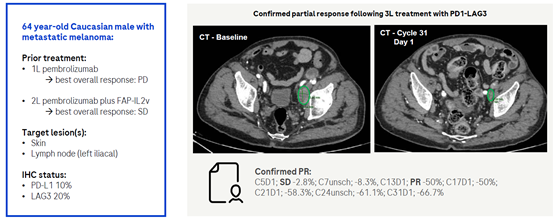
3.1 PD-1/LAG-3双特异抗体
2022年3月18日,BMS(百时美施贵宝)宣布,其PD-1+LAG-3联合疗法OPDUALAG获得FDA批准上市,用于治疗12岁及以上不可切成或者转移性黑色素瘤的患者。该疗法的获批证明了LAG-3免疫检查点的有效性。国内外已经有多家公司在开发PD-1/LAG-3双特异抗体双特异抗体,罗氏的PD-1/LAG-3双抗在临床前研究中和CEACAM5/CD3双抗联合使用展现了良好的疗效。目前该抗体已经完成剂量爬坡,正在进行1/2期临床实验,主要研究其作为单药在食道癌,肝癌等肿瘤中的疗效。

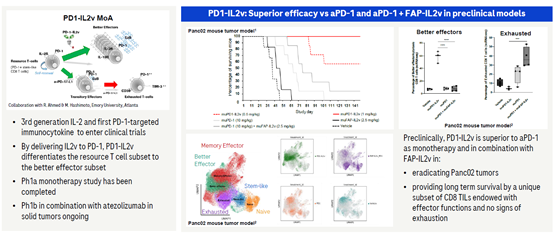
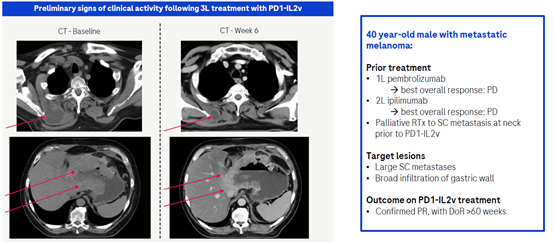
3.2 PD-1/IL2v(RG6279)
RG6279为靶向PD-1和IL2的抗体融合蛋白,其在PD- 1抗体的Fc端融合了一个IL-2变体。这个IL-2变体通过设计消除了与IL-2Rα的结合,从而避免了它与内皮细胞的结合,同时消除了导致调节性T细胞(Treg)扩增的功能。它能够具有特异性地将IL-2变体递送到表达PD-1的T细胞附近,与传统的PD-1抗体相比,能够更有效地激发具有细胞毒性的效应T细胞的扩增。在早期的临床中,PD-1/IL2v的治疗在一位接受三线治疗的转移性黑色素瘤患者中观察到了肿瘤的消退。
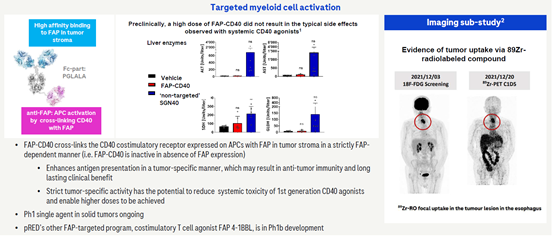
3.3 FAP-CD40(RG6189)
CD40激动剂由于能够增强树突状细胞(DC)的激活和伴随的肿瘤特异性T细胞启动,使得该靶点在癌症免疫治疗中具有很好的前景,但是CD40的广泛表达导致的剂量限制性副反应,如细胞因子释放综合征(CRS)和肝毒性,以及CD40受体在造血和非造血细胞上的广泛表达,造成的吸收作用(sink effect)导致激动性抗CD40分子表现出非常短的血清半衰期,从而限制了CD40抗体的疗效。
罗氏已经放弃了之前CD40单克隆抗体,转而开发FAP/CD40双特异抗体,其主要是通过FAP将CD40定位到肿瘤中,使其在肿瘤中发挥激动剂的功能,从而防止相关副作用。目前该双特异抗体已经进入临床,用于实体瘤的治疗。
Genentech管线
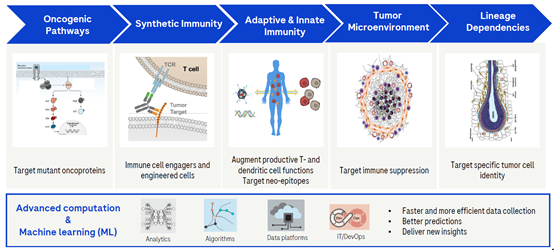
作为罗氏的一部分,Genentech一直以来以科学创新为导向,凭借着坚实过硬的科学技术,Genentech已经成功开发了多种药物,包括鼎鼎大名的Rituxan(美罗华)和Herceptin(曲妥珠单抗)。在肿瘤治疗领域,其也是全方位布局,包括致癌基因通路相关药物开发,合成型免疫药物开发,获得性或者自然免疫药物开发以及肿瘤微环境相关药物的开发等。
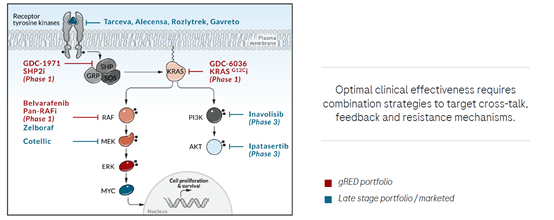
4.1 RAS-MAPK通路
在致癌基因通路中,genentech目前主要布局RAS-MAPK通路,围绕该通路,其已经有多个药物在开发中,其中处于临床早期的包括GDC-6036:一款靶向KRAS G12C的共价抑制剂,它能够不可逆地将KRAS G12C固定在失活状态;belvarafenib:一款抑制RAF二聚体的抑制剂。它能够阻断NRAS的下游信号通路;GDC-1971:一款口服选择性SHP2抑制剂,它与KRAS G12C抑制剂联用,在临床前模型中表现出协同作用。在未来发展中,罗氏将会联合使用通路中不同靶点的相关药物,在提高抗肿瘤疗效的同时防止耐药性的产生。
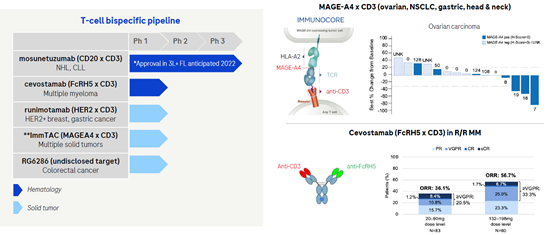
4.2 激活T细胞的双特异抗体
在CD3双特异抗体开发方面,Genentech开发的CD20/CD3双特异抗体Mosunetuzumab已经在欧洲获批。除此之外,其还开发了FcRH5/CD3,Her3/CD3,MAGEA4/CD3等双特异抗体,这些双抗用于血液瘤或者实体瘤的治疗。
FcRH5是一种含有Ig结构域的I型膜蛋白,现有的研究表明FcRH5仅在B细胞谱系中表达,而且在骨髓瘤细胞上的表达率高于正常B细胞。cevostamab是罗氏首创的FcRH5xCD3 T细胞结合双特异性抗体,通过同时靶向骨髓瘤细胞上的FcRH5和T细胞表面的CD3发挥作用。现有的临床数据表明,在RR/MM肿瘤中,高剂量组治疗的ORR为56.7%,其中VGPR或者更好为33.3%,该疗法也许在将来会是BCMA,GPRC5D等靶向治疗耐药后的另外一种选择。
MAGEA4/CD3双抗是Genentech和 Immunocore联合开发的双特异抗体,该分子的构建采用了Immunocore公司的ImmTAC 平台,目前已经在临床开发中。
4.3 靶向肿瘤微环境
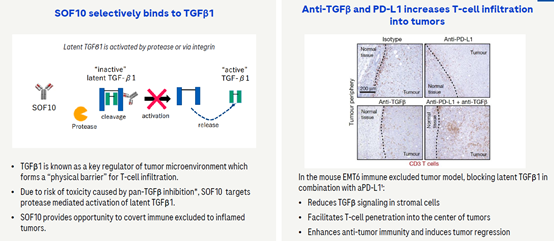
TGF-β是一种多功能转化生长因子,在体内,TGF-β/Smads细胞信号转导通路受到多种机制的特异性调控,其信号转导异常则与多种疾病相关联,如胚胎发育异常、肿瘤、组织纤维化等疾病。TGF-β1在激活前以没有活性的复合物存在,在一些酶如金属蛋白酶等的作用下,其可以成为有活性的TGF-β1,罗氏的SOF10可以结合在酶切位点,从而防止TGF-β1的激活。另外,该抗体仅和TGF-β1前体结合,因此理论上不会有传统TGF-β抗体的相关毒性。在小鼠模型中,SOF10和PD-L1抗体联合使用可以有效的增加T细胞的浸润,从而增强机体对肿瘤的控制。
4.4 个性化肿瘤疗法
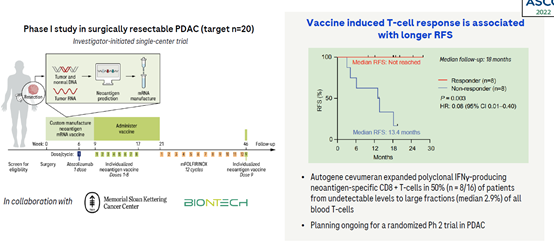
这类疗法主要根据病人,或者特定的肿瘤进行个性化设计治疗。如对肿瘤患者的血液或者其它生物标本进行分析,筛选肿瘤特异性突变并获得新型抗原,然后利用这些特异性抗原进行DNA或者RNA疫苗的制备,或者是筛选特异性TCR并对T细胞进行改造构建能够特异性识别患者新抗原的T细胞,利用改造后的T细胞进行治疗。目前这些新型疗法的开发,罗氏主要是通过和外部生物科技合作进行布局。

罗氏与BioNTech联合开发的基于mRNA的个体化新抗原特异性免疫疗法(iNeST)autogene cevumeran (BNT122),与PD-L1抑制剂atezolizumab和化疗联用,用于治疗接受手术切除的胰腺癌患者。在I期临床中,16位患者手术后9周接受治疗并接受评估,其中8位患者检测到了新抗原特异性CD8T细胞,并且与没有反应的患者相比,这些患者的生存期明显延长。
总结
做药难,做创新药更难,但是在医药技术更新迭代速度越来越快的今天,不创新就可能意味着被淘汰。罗氏作为医药界的巨头,其也是不断的通过创新维持现有的地位,这些创新包括新靶点,新组合,新的给药方式等。在肿瘤领域的布局,除了之前已经开发的靶向Her2的单抗,ADC等药物,罗氏已经在大力布局双特异抗体领域,包括靶向Her2的双抗,靶向血液瘤多个靶点的双抗,并且也在临床中探索双特异抗体和双特异抗体的联合,这一点从目前罗氏获批的双抗也可见一斑(全球目前有5款双抗,罗氏独占3款)。当然,除了在抗体领域的布局,罗氏也在布局小分子药物,如治疗乳腺癌的inavolisib和giredestrant,靶向RAS-MAPK通路相关小分子药物等。
版权声明:本网站所有注明来源“医微客”的文字、图片和音视频资料,版权均属于医微客所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源:”医微客”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,转载仅作观点分享,版权归原作者所有。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 本站拥有对此声明的最终解释权。





发表评论
注册或登后即可发表评论
登录注册
全部评论(0)